การศึกษาคุณสมบัติของก๊าซในอุดมคติเป็นหัวข้อที่สำคัญในวิชาฟิสิกส์ ข้อมูลเบื้องต้นเกี่ยวกับคุณลักษณะของระบบแก๊สเริ่มต้นด้วยการพิจารณาสมการบอยล์-มาริออตต์ เนื่องจากเป็นกฎข้อแรกที่ค้นพบโดยการทดลองเกี่ยวกับก๊าซในอุดมคติ พิจารณารายละเอียดเพิ่มเติมในบทความครับ
ก๊าซในอุดมคติหมายถึงอะไร
ก่อนจะพูดถึงกฎของบอยล์-มาริออตต์และสมการที่อธิบาย เรามานิยามแก๊สในอุดมคติกันก่อน เป็นที่เข้าใจกันโดยทั่วไปว่าเป็นสารของไหลซึ่งอนุภาคที่ประกอบเป็นส่วนประกอบไม่มีปฏิกิริยาระหว่างกัน และขนาดของอนุภาคนั้นเล็กเล็กน้อยเมื่อเทียบกับระยะห่างระหว่างอนุภาคโดยเฉลี่ย
อันที่จริง ก๊าซใด ๆ ก็ตามที่มีจริง กล่าวคือ อะตอมและโมเลกุลที่เป็นส่วนประกอบจะมีขนาดที่แน่นอนและไม่โต้ตอบกันด้วยความช่วยเหลือของกองกำลังแวนเดอร์วาลส์ อย่างไรก็ตาม ที่อุณหภูมิสัมบูรณ์สูง (มากกว่า 300 K) และความดันต่ำ (น้อยกว่า 1 บรรยากาศ) พลังงานจลน์ของอะตอมและโมเลกุลจะสูงกว่าพลังงานของปฏิกิริยา Van der Waals มาก ดังนั้นก๊าซจริงตามที่ระบุเงื่อนไขที่มีความแม่นยำสูงถือได้ว่าเป็นอุดมคติ
สมการบอยล์-มาริออตต์
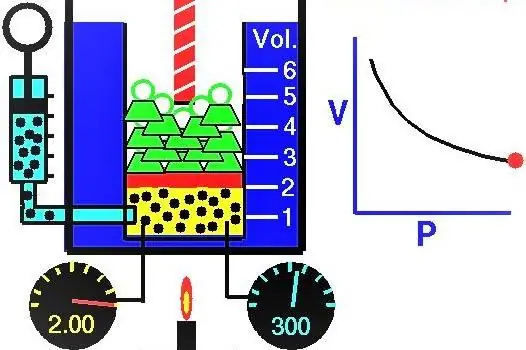
คุณสมบัติของก๊าซที่นักวิทยาศาสตร์ชาวยุโรปทำการสำรวจในช่วงศตวรรษที่ XVII-XIX กฎแก๊สข้อแรกที่ค้นพบในการทดลองคือกฎที่อธิบายกระบวนการไอโซเทอร์มอลของการขยายตัวและการอัดของระบบแก๊ส การทดลองที่สอดคล้องกันได้ดำเนินการโดย Robert Boyle ในปี 1662 และ Edm Mariotte ในปี 1676 นักวิทยาศาสตร์แต่ละคนแสดงให้เห็นอย่างเป็นอิสระว่าในระหว่างกระบวนการเก็บอุณหภูมิในระบบแก๊สปิด ความดันจะเปลี่ยนผกผันกับปริมาตร นิพจน์ทางคณิตศาสตร์ที่ได้รับจากการทดลองของกระบวนการเขียนในรูปแบบต่อไปนี้:
PV=k
โดยที่ P และ V คือความดันในระบบและปริมาตร k คือค่าคงที่บางค่า ซึ่งขึ้นอยู่กับปริมาณของสารในแก๊สและอุณหภูมิ หากคุณสร้างการพึ่งพาฟังก์ชัน P(V) บนกราฟ กราฟจะเป็นไฮเปอร์โบลา ตัวอย่างของเส้นโค้งเหล่านี้แสดงอยู่ด้านล่าง
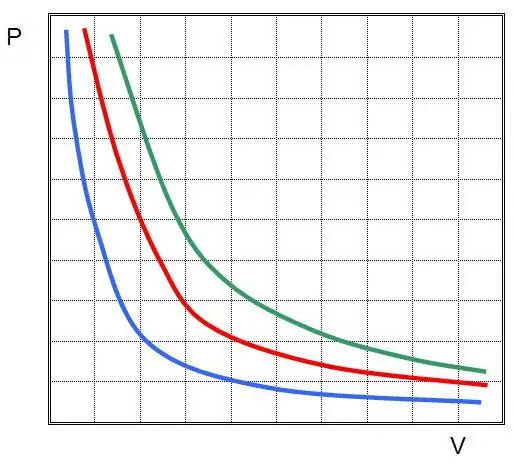
ความเท่าเทียมกันในการเขียนเรียกว่าสมการ Boyle-Mariotte (กฎหมาย) กฎข้อนี้สามารถกำหนดได้สั้น ๆ ดังต่อไปนี้: การขยายตัวของก๊าซในอุดมคติที่อุณหภูมิคงที่จะทำให้ความดันลดลงตามสัดส่วน ในทางกลับกัน การบีบอัดอุณหภูมิความร้อนของระบบแก๊สจะมาพร้อมกับความดันที่เพิ่มขึ้นตามสัดส่วน
สมการก๊าซในอุดมคติ
Boyle-Mariotte law เป็นกรณีพิเศษของกฎหมายทั่วไปที่มีชื่อของ Mendeleev และแคลเปรอน. Emile Clapeyron ซึ่งสรุปข้อมูลการทดลองเกี่ยวกับพฤติกรรมของก๊าซภายใต้สภาวะภายนอกต่างๆ ในปี พ.ศ. 2377 ได้สมการดังนี้
PV=nRT
กล่าวอีกนัยหนึ่ง ผลิตภัณฑ์ของปริมาตร V ของระบบแก๊สและความดัน P ในนั้นจะเป็นสัดส่วนโดยตรงกับผลคูณของอุณหภูมิสัมบูรณ์ T และปริมาณของสาร n สัมประสิทธิ์ของสัดส่วนนี้แสดงด้วยตัวอักษร R และเรียกว่าค่าคงที่สากลของแก๊ส ในสมการที่เขียน ค่าของ R ปรากฏขึ้นเนื่องจากการแทนที่ค่าคงที่จำนวนหนึ่งซึ่งสร้างโดย Dmitry Ivanovich Mendeleev ในปี 1874
จากสมการสากลของสภาวะ จะสังเกตได้ง่ายว่าความคงตัวของอุณหภูมิและปริมาณของสารรับรองค่าคงที่ทางด้านขวาของสมการ ซึ่งหมายความว่าด้านซ้ายของสมการจะยังคงคงที่. ในกรณีนี้ เราจะได้สมการ Boyle-Mariotte

กฎหมายแก๊สอื่นๆ
สมการ Clapeyron-Mendeleev ที่เขียนในย่อหน้าด้านบนมีพารามิเตอร์ทางอุณหพลศาสตร์สามตัว: P, V และ T หากแต่ละค่าคงที่และอีกสองตัวได้รับอนุญาตให้เปลี่ยน เราก็จะได้ Boyle-Mariotte สมการชาร์ลส์และเกย์-ลูสแซก กฎของชาร์ลส์กล่าวถึงสัดส่วนโดยตรงระหว่างปริมาตรและอุณหภูมิสำหรับกระบวนการไอโซบาริก และกฎของเก-ลุสแซกระบุว่าในกรณีของการเปลี่ยนแปลงไอโซโคริก แรงดันแก๊สจะเพิ่มขึ้นหรือลดลงในสัดส่วนโดยตรงกับอุณหภูมิสัมบูรณ์ สมการที่สอดคล้องกันมีลักษณะดังนี้:
V/T=const เมื่อ P=const;
P/T=const เมื่อ V=const.
โซดังนั้น กฎของบอยล์-มาริออตต์จึงเป็นหนึ่งในสามกฎหลักของแก๊ส อย่างไรก็ตาม มันแตกต่างจากส่วนที่เหลือในแง่ของการพึ่งพากราฟิก: ฟังก์ชัน V(T) และ P(T) เป็นเส้นตรง ฟังก์ชัน P(V) เป็นไฮเปอร์โบลา
ตัวอย่างงานการใช้กฎหมายบอยล์-มาริออตต์
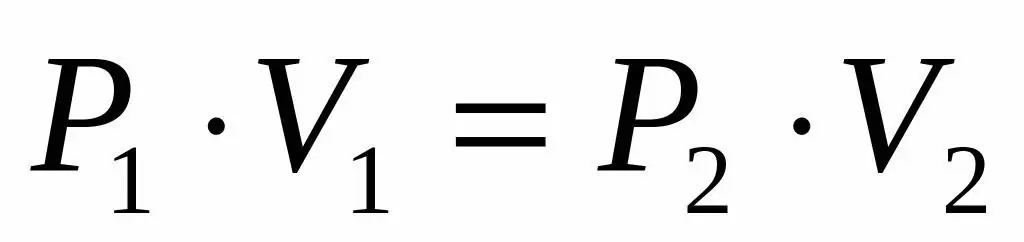
ปริมาตรของแก๊สในกระบอกสูบใต้ลูกสูบในตำแหน่งเริ่มต้นคือ 2 ลิตร และแรงดันคือ 1 บรรยากาศ ความดันของแก๊สหลังจากลูกสูบเพิ่มขึ้นเป็นเท่าใด และปริมาตรของระบบแก๊สเพิ่มขึ้น 0.5 ลิตร กระบวนการนี้ถือเป็นอุณหภูมิความร้อน
เนื่องจากเราได้รับความดันและปริมาตรของก๊าซในอุดมคติ และเรายังทราบด้วยว่าอุณหภูมิยังคงไม่เปลี่ยนแปลงในระหว่างการขยายตัว เราจึงสามารถใช้สมการ Boyle-Mariotte ในรูปแบบต่อไปนี้:
P1V1=P2V 2
ความเท่าเทียมกันนี้บอกว่าผลิตภัณฑ์แรงดันปริมาตรจะคงที่สำหรับก๊าซทุกสถานะที่อุณหภูมิที่กำหนด แสดงค่า P2 จากความเท่าเทียมกัน เราได้รับสูตรสุดท้าย:
P2=P1V1/V 2
เมื่อทำการคำนวณแรงดัน คุณสามารถใช้หน่วยนอกระบบในกรณีนี้ เนื่องจากลิตรจะหดตัว และเราจะได้แรงดัน P2ในบรรยากาศ แทนที่ข้อมูลจากเงื่อนไข เรามาถึงคำตอบสำหรับคำถามของปัญหา: P2=0.8 บรรยากาศ






