หนึ่งในคำถามสำคัญในการศึกษาระบบเทอร์โมไดนามิกส์ในวิชาฟิสิกส์คือคำถามที่ว่าระบบนี้สามารถทำงานได้ที่เป็นประโยชน์หรือไม่ แนวความคิดที่เกี่ยวข้องกับงานอย่างใกล้ชิดคือแนวคิดเรื่องพลังงานภายใน ในบทความนี้ เราจะพิจารณาว่าพลังงานภายในของก๊าซในอุดมคติคืออะไร และให้สูตรในการคำนวณ
แก๊สในอุดมคติ
เกี่ยวกับแก๊สเนื่องจากสถานะของการรวมตัวซึ่งไม่มีแรงยืดหยุ่นใด ๆ ภายใต้อิทธิพลภายนอกและด้วยเหตุนี้จึงไม่รักษาปริมาตรและรูปร่างเด็กนักเรียนทุกคนรู้ แนวคิดเรื่องก๊าซในอุดมคติสำหรับหลายๆ คนยังคงเข้าใจยากและไม่ชัดเจน อธิบายหน่อย
ก๊าซในอุดมคติคือก๊าซใด ๆ ที่ตรงตามเงื่อนไขสำคัญสองประการต่อไปนี้:
- อนุภาคที่ประกอบขึ้นไม่มีขนาด พวกมันมีขนาด แต่มันเล็กมากเมื่อเทียบกับระยะห่างระหว่างพวกมันจนสามารถละเลยในการคำนวณทางคณิตศาสตร์ทั้งหมดได้
- อนุภาคไม่โต้ตอบกันโดยใช้กำลังหรือกองกำลังของแวนเดอร์วาลส์ธรรมชาติอื่น ๆ อันที่จริงแล้ว ในก๊าซจริงทั้งหมด ปฏิกิริยาดังกล่าวมีอยู่ แต่พลังงานของมันมีน้อยมากเมื่อเทียบกับพลังงานเฉลี่ยของอนุภาคจลน์
ก๊าซจริงเกือบทั้งหมดเป็นไปตามเงื่อนไขที่อธิบายไว้ ซึ่งมีอุณหภูมิสูงกว่า 300 K และความดันไม่เกินหนึ่งบรรยากาศ สำหรับความดันสูงเกินไปและอุณหภูมิต่ำ จะสังเกตการเบี่ยงเบนของก๊าซจากพฤติกรรมในอุดมคติ ในกรณีนี้ มีคนพูดถึงก๊าซจริง อธิบายโดยสมการ van der Waals
แนวคิดเรื่องพลังงานภายในของก๊าซในอุดมคติ
ตามคำจำกัดความ พลังงานภายในของระบบคือผลรวมของพลังงานจลน์และพลังงานที่อาจเกิดขึ้นภายในระบบนี้ หากแนวคิดนี้ใช้กับก๊าซในอุดมคติ ก็ควรละทิ้งส่วนประกอบที่มีศักยภาพ อันที่จริง เนื่องจากอนุภาคของก๊าซในอุดมคติไม่มีปฏิสัมพันธ์ซึ่งกันและกัน จึงถือได้ว่าเคลื่อนที่อย่างอิสระในสุญญากาศสัมบูรณ์ ในการดึงอนุภาคออกจากระบบที่กำลังศึกษาอยู่นั้น ไม่จำเป็นต้องทำงานกับแรงปฏิสัมพันธ์ภายใน เนื่องจากไม่มีแรงเหล่านี้
ดังนั้น พลังงานภายในของก๊าซในอุดมคติจึงเกิดขึ้นพร้อมกับพลังงานจลน์เสมอ ในทางกลับกันถูกกำหนดโดยมวลโมลาร์ของอนุภาคของระบบจำนวนของมันรวมถึงความเร็วเฉลี่ยของการเคลื่อนที่เชิงแปลและการหมุน ความเร็วในการเคลื่อนที่ขึ้นอยู่กับอุณหภูมิ อุณหภูมิที่เพิ่มขึ้นทำให้พลังงานภายในเพิ่มขึ้น และในทางกลับกัน
สูตรสำหรับพลังงานภายใน
ระบุพลังงานภายในของระบบก๊าซในอุดมคติด้วยตัวอักษร U ตามอุณหพลศาสตร์ มันถูกกำหนดให้เป็นความแตกต่างระหว่างเอนทาลปี H ของระบบกับผลคูณของแรงดันและปริมาตร นั่นคือ:
U=H - pV.
ในย่อหน้าด้านบน เราพบว่าค่าของ U สอดคล้องกับพลังงานจลน์ทั้งหมด Ekของอนุภาคก๊าซทั้งหมด:
U=Ek.
จากกลศาสตร์ทางสถิติ ภายใต้กรอบของทฤษฎีจลนพลศาสตร์ระดับโมเลกุล (MKT) ของก๊าซในอุดมคติ พลังงานจลน์เฉลี่ยของอนุภาค Ek1 เท่ากับ ค่าต่อไปนี้:
Ek1=z/2kBT.
ที่นี่ kB และ T - ค่าคงที่และอุณหภูมิ Boltzmann, z - จำนวนองศาอิสระ พลังงานจลน์ทั้งหมดของระบบ Ek สามารถหาได้จากการคูณ Ek1 ด้วยจำนวนอนุภาค N ในระบบ:
Ek=NEk1=z/2NkBT.
ดังนั้นเราจึงได้สูตรสำหรับพลังงานภายในของก๊าซอุดมคติ เขียนในรูปแบบทั่วไปในแง่ของอุณหภูมิสัมบูรณ์และจำนวนของอนุภาคในระบบปิด:
U=z/2NkBT.
ก๊าซโมโนอะตอมและโพลิอะตอมมิก
สูตรสำหรับ U ที่เขียนในย่อหน้าก่อนหน้าของบทความนั้นไม่สะดวกในการใช้งานจริง เนื่องจากยากต่อการกำหนดจำนวนอนุภาค N อย่างไรก็ตาม หากเราคำนึงถึงคำจำกัดความของปริมาณของสาร n นิพจน์นี้สามารถเขียนใหม่ในรูปแบบที่สะดวกยิ่งขึ้น:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
จำนวนองศาอิสระ z ขึ้นอยู่กับเรขาคณิตของอนุภาคที่ประกอบเป็นแก๊ส ดังนั้น สำหรับก๊าซอะตอมเดี่ยว z=3 เนื่องจากอะตอมสามารถเคลื่อนที่ได้อย่างอิสระในอวกาศสามทิศทางเท่านั้น หากก๊าซเป็นไดอะตอมมิก ดังนั้น z=5 เนื่องจากองศาอิสระในการหมุนอีกสององศาจะถูกเพิ่มเข้าไปในองศาอิสระการแปลสามระดับ สุดท้าย สำหรับก๊าซ polyatomic อื่น ๆ z=6 (3 การแปลและ 3 องศาการหมุนอิสระ) เมื่อคำนึงถึงสิ่งนี้ เราสามารถเขียนสูตรพลังงานภายในของก๊าซในอุดมคติของ monatomic, diatomic และ polyatomic ในรูปแบบต่อไปนี้:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
ตัวอย่างงานกำหนดพลังงานภายใน
ถังขนาด 100 ลิตรบรรจุไฮโดรเจนบริสุทธิ์ที่ความดัน 3 บรรยากาศ สมมติว่าไฮโดรเจนเป็นก๊าซในอุดมคติภายใต้สภาวะที่กำหนด จำเป็นต้องพิจารณาว่าพลังงานภายในมันคืออะไร

สูตรข้างต้นสำหรับ U มีปริมาณของสารและอุณหภูมิของก๊าซ ในสภาพของปัญหา ไม่มีการพูดถึงปริมาณเหล่านี้อย่างแน่นอน เพื่อแก้ปัญหานี้ จำเป็นต้องจำสมการสากลของ Clapeyron-Mendeleev มีลักษณะตามรูป
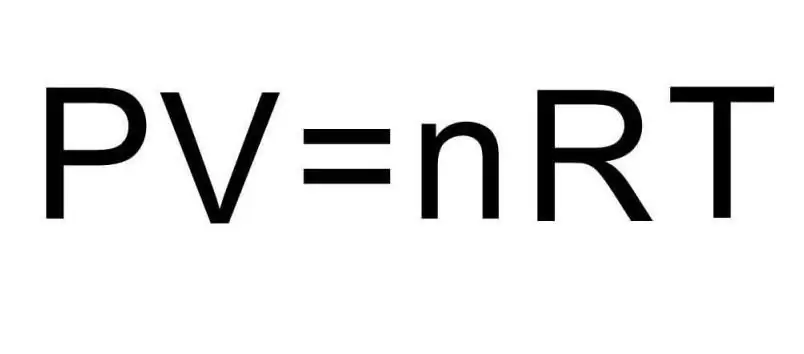
เนื่องจากไฮโดรเจน H2 เป็นโมเลกุลไดอะตอมมิก สูตรสำหรับพลังงานภายในคือ:
UH2=5/2nRT.
เปรียบเทียบทั้งสองนิพจน์ เรามาถึงสูตรสุดท้ายสำหรับการแก้ปัญหา:
UH2=5/2PV.
ยังคงต้องแปลงหน่วยของแรงดันและปริมาตรจากเงื่อนไขเป็นระบบ SI ของหน่วย แทนที่ค่าที่สอดคล้องกันในสูตรสำหรับ UH2 และรับ คำตอบ: UH2 ≈ 76 kJ.




