วิธีการวิเคราะห์ conductometric คือการวัดค่าการนำไฟฟ้าเพื่อติดตามความคืบหน้าของปฏิกิริยาเคมี วิทยาศาสตร์นี้ใช้กันอย่างแพร่หลายในเคมีวิเคราะห์ โดยที่การไทเทรตเป็นวิธีการทำงานมาตรฐาน conductometry คืออะไร? ในทางปฏิบัติทั่วไปในวิชาเคมีวิเคราะห์ คำนี้ใช้เป็นคำพ้องความหมายสำหรับการไทเทรต ในขณะที่ยังใช้เพื่ออธิบายการใช้งานที่ไม่ใช่การไทเทรต ประโยชน์ของการใช้วิธีการวิเคราะห์นี้มีประโยชน์อย่างไร? มักใช้เพื่อกำหนดค่าการนำไฟฟ้าโดยรวมของสารละลายหรือเพื่อวิเคราะห์จุดสิ้นสุดของการไทเทรตที่เกี่ยวข้องกับไอออน
ประวัติศาสตร์
การวัดค่าการนำไฟฟ้าเริ่มขึ้นในศตวรรษที่ 18 เมื่อ Andreas Baumgartner สังเกตว่าเกลือและน้ำแร่จาก Bad Gastein ในออสเตรียนำไฟฟ้า ดังนั้น การใช้วิธีนี้เพื่อกำหนดความบริสุทธิ์ของน้ำ ซึ่งปัจจุบันมักใช้ในการทดสอบประสิทธิภาพของระบบทำน้ำให้บริสุทธิ์ เริ่มขึ้นในปี พ.ศ. 2319 จึงเริ่มต้นประวัติศาสตร์ของวิธีการวิเคราะห์ conductometric
ฟรีดริช โคห์ลเราช์ ยังคงพัฒนาวิทยาศาสตร์นี้ต่อไปในยุค 1860 เมื่อเขาใช้กระแสสลับกับน้ำ กรด และสารละลายอื่นๆ ในช่วงเวลานี้ วิลลิส วิทนีย์ ซึ่งกำลังศึกษาปฏิกิริยาระหว่างกรดซัลฟิวริกและสารเชิงซ้อนของโครเมียมซัลเฟต ได้ค้นพบจุดสิ้นสุดการนำไฟฟ้าจุดแรก การค้นพบนี้มีผลสูงสุดในการไทเทรตแบบโพเทนชิโอเมตริก และเป็นเครื่องมือแรกสำหรับการวิเคราะห์เชิงปริมาตรโดย Robert Behrend ในปี 1883 ในการไทเทรตคลอไรด์และโบรไมด์ HgNO3 ดังนั้น วิธีการวิเคราะห์ conductometric สมัยใหม่จึงขึ้นอยู่กับ Behrend
การพัฒนานี้ทำให้สามารถทดสอบความสามารถในการละลายของเกลือและความเข้มข้นของไฮโดรเจนไอออน รวมถึงการไทเทรตกรด-เบสและรีดอกซ์ วิธีการวิเคราะห์การนำไฟฟ้าได้รับการปรับปรุงด้วยการพัฒนาอิเล็กโทรดแก้ว ซึ่งเริ่มในปี 1909
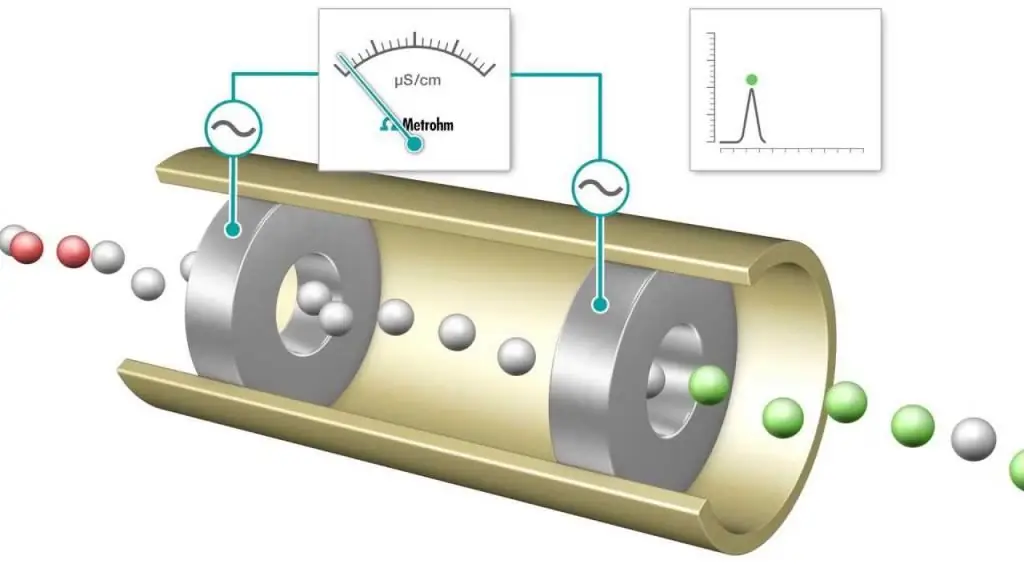
การไทเทรต
การไทเทรตแบบสื่อกระแสไฟฟ้าคือการวัดที่การนำไฟฟ้าของส่วนผสมของปฏิกิริยาจะได้รับการตรวจสอบอย่างต่อเนื่องโดยการเพิ่มสารทำปฏิกิริยาหนึ่งตัว จุดสมมูลคือจุดที่ค่าการนำไฟฟ้าเปลี่ยนแปลงกะทันหัน การนำไฟฟ้าที่เพิ่มขึ้นหรือลดลงอย่างเห็นได้ชัดสัมพันธ์กับการเปลี่ยนแปลงความเข้มข้นของไอออนนำไฟฟ้าสูงที่สุดสองชนิด ได้แก่ ไฮโดรเจนและไฮดรอกไซด์ไอออน วิธีนี้สามารถใช้ในการไทเทรตสารละลายที่มีสีหรือสารแขวนลอยที่เป็นเนื้อเดียวกัน (เช่น สารแขวนลอยเยื่อไม้) ซึ่งไม่สามารถใช้กับตัวบ่งชี้ทั่วไปได้
มักใช้การไทเทรตกรด-เบสและรีดอกซ์ ซึ่งใช้ตัวบ่งชี้ทั่วไปเพื่อระบุจุดสิ้นสุด เช่น เมทิลออเรนจ์ ฟีนอฟทาลีนสำหรับการไทเทรตกรด-เบส และสารละลายแป้งสำหรับกระบวนการรีดอกซ์ประเภทไอโอโดเมตริก อย่างไรก็ตาม การวัดค่าการนำไฟฟ้ายังสามารถใช้เป็นเครื่องมือในการกำหนดจุดสิ้นสุดได้ เช่น เมื่อสังเกตสารละลายของ HCl ด้วย NaOH ฐานที่แข็งแรง
การทำให้เป็นกลางโปรตอน
ในขณะที่การไทเทรตดำเนินไป โปรตอนจะถูกทำให้เป็นกลางเพื่อสร้าง NaOH โดยสร้างน้ำ สำหรับแต่ละปริมาณของ NaOH ที่เติม จะมีการกำจัดไฮโดรเจนไอออนในจำนวนที่เท่ากัน ผลที่ได้คือ H+ cation แบบเคลื่อนที่จะถูกแทนที่ด้วย Na+ ion ที่เคลื่อนที่ได้น้อยกว่า และความนำของสารละลายที่ไตเตรท ตลอดจนค่าการนำไฟฟ้าของเซลล์ที่วัดได้ลดลง สิ่งนี้จะดำเนินต่อไปจนกว่าจะถึงจุดสมมูลซึ่งสามารถหาสารละลายโซเดียมคลอไรด์ NaCl ได้ หากเติมเบสมากขึ้น ก็จะเพิ่มขึ้นเมื่อมีการเติมไอออน Na+ และ OH- มากขึ้นและปฏิกิริยาการวางตัวเป็นกลางจะไม่กำจัด H+ ในปริมาณที่เห็นได้อีกต่อไป

ดังนั้น เมื่อกรดแก่ถูกไทเทรตกับเบสแก่ ค่าการนำไฟฟ้าจะมีค่าต่ำสุดที่จุดสมมูล ขั้นต่ำนี้สามารถใช้แทนสีย้อมตัวบ่งชี้เพื่อกำหนดจุดสิ้นสุดของการไทเทรต กราฟการไทเทรตคือกราฟของค่าการนำไฟฟ้าหรือการนำไฟฟ้าที่วัดได้ ตามฟังก์ชันของปริมาตรของสารละลาย NaOH ที่เพิ่มเข้ามา กราฟการไทเทรตสามารถใช้เพื่อกำหนดจุดสมมูลแบบกราฟิกได้ วิธีการวิเคราะห์ conductometric (และการใช้งาน) มีความเกี่ยวข้องอย่างยิ่งในวิชาเคมีสมัยใหม่
ปฏิกิริยา
สำหรับปฏิกิริยาระหว่างเบสอ่อนที่เป็นกรดอ่อนๆ ค่าการนำไฟฟ้าจะลดลงบ้างในตอนแรก เนื่องจากมีการใช้ไอออน H+ เพียงเล็กน้อย จากนั้นค่าการนำไฟฟ้าจะเพิ่มขึ้นเล็กน้อยจนถึงปริมาตรของจุดสมมูลอันเนื่องมาจากการมีส่วนร่วมของเกลือไอออนบวกและประจุลบ (ส่วนนี้ในกรณีของเบสที่เป็นกรดแก่จะน้อยมากและไม่นำมาพิจารณาที่นั่น) หลังจากถึงจุดสมมูล การนำไฟฟ้าเพิ่มขึ้นอย่างรวดเร็วเนื่องจากมีไอออน OH มากเกินไป
เครื่องตรวจจับค่าการนำไฟฟ้า (วิธีการวิเคราะห์แบบการนำไฟฟ้า) ยังใช้เพื่อวัดความเข้มข้นของอิเล็กโทรไลต์ในสารละลายที่เป็นน้ำ ความเข้มข้นของโมลาร์ของสารวิเคราะห์ที่สร้างการนำไฟฟ้าของสารละลายสามารถหาได้จากความต้านทานไฟฟ้าที่วัดได้ของสารละลาย
วิธีวิเคราะห์การนำไฟฟ้า: หลักการและสูตร
(2.4.13) C=Constcell1Λm1Res โดยที่ Constcell เป็นค่าคงที่ขึ้นอยู่กับเซลล์การวัด Res คือความต้านทานไฟฟ้าที่วัดโดยอุปกรณ์ (ตามกฎของโอห์ม Res=I / V และมีค่าคงที่ การวัดแรงดันไฟฟ้า V I ความเข้มช่วยให้คุณคำนวณ Res) และ Λm มีค่าเท่ากันการนำไฟฟ้าสำหรับอนุภาคไอออนิก แม้ว่าในทางปฏิบัติ Λm ถือว่าคงที่ แต่ก็ขึ้นอยู่กับความเข้มข้นตามกฎของ Kohlrausch:
(2.4.14)=Хт Λm0-ΘC โดยที่ Θ เป็นค่าคงที่ และ Λm0 คือลักษณะเฉพาะการนำไฟฟ้าโมลาร์ที่จำกัดของแต่ละไอออน ในทางกลับกันค่าการนำไฟฟ้ากรามก็ขึ้นอยู่กับอุณหภูมิ
สคริป
การพัฒนาวิธีการวิเคราะห์การวัดแบบ conductometric ได้นำนักวิทยาศาสตร์ไปสู่การค้นพบใหม่ นักวิทยาศาสตร์ได้กำหนดอัตราส่วนความอิ่มตัวยิ่งยวดวิกฤต Scrit โดยใช้ conductometry ในระบบตกตะกอน AgCl ที่เป็นเนื้อเดียวกันมากกว่า Ag+ ไอออน โดยใช้การไฮโดรไลซิสของอัลคิลคลอไรด์เป็นแหล่งของไอออน CI” พวกเขาพบ Scrit=1.51, 1.73 และ 1.85 ที่ 15, 25 และ 35°C ตามลำดับ โดยที่ S=([Ag+][Cl-] / Ksp) 1/2 ตามคำจำกัดความ หากคำจำกัดความของปัจจัยอิ่มตัวยิ่งยวดนี้แปลงเป็นค่าของเรา (S=[Ag+][Cl-] / Ksp) ผลลัพธ์จะเป็น 2.28, 2.99 และ 3.42 ตามลำดับ ซึ่งค่อนข้างสอดคล้องกับผลการศึกษาในปัจจุบัน อย่างไรก็ตาม การพึ่งพาอุณหภูมิของ Scrit นั้นตรงกันข้ามกับที่อธิบายไว้ในการศึกษานี้ แม้ว่าสาเหตุของความขัดแย้งนี้จะไม่ชัดเจนนัก การลดลงของ Scrit ด้วยอุณหภูมิที่เพิ่มขึ้นอาจค่อนข้างสมเหตุสมผล เนื่องจากอัตราการเกิดนิวเคลียสเปลี่ยนแปลงอย่างมากโดยมีการเปลี่ยนแปลงเล็กน้อยใน ΔGm/ kT และด้วยเหตุนี้ ΔGm/ kT ซึ่งเป็นสัดส่วนกับ T − 3 (lnSm) 2 ตามสูตร (1.4.12) ถือว่าเกือบคงที่เมื่ออุณหภูมิเปลี่ยนแปลงในระบบที่กำหนด อนึ่ง คำจำกัดความของ S ต้องเป็น [Ag +] [Cl -] / Ksp เนื่องจากอัตราส่วนความอิ่มตัวของสีสูงในแง่ของ[AgCl] ความเข้มข้นของโมโนเมอร์เริ่มต้นเป็น S=[AgCl] / [AgCl] (∞)=[Ag +] [Cl -] / Ksp.
ทานากะและอิวาซากิ
ประวัติของวิธีการวิเคราะห์ conductometric ยังคงดำเนินต่อไปโดยนักวิทยาศาสตร์ชาวญี่ปุ่นที่มีชื่อเสียงสองคน ทานากะและอิวาซากิศึกษากระบวนการสร้างนิวเคลียสของอนุภาค AgCl และ AgBr โดยใช้วิธีหยุดการไหลร่วมกับสเปกโตรโฟโตมิเตอร์แบบหลายช่องสัญญาณ ซึ่งเป็นประโยชน์สำหรับการศึกษากระบวนการที่รวดเร็วตามลำดับ msec พวกเขาพบว่า AgXm คอมเพล็กซ์ซิลเวอร์เฮไลด์จำเพาะบางตัว (m-1) ซึ่งมีแถบดูดกลืน UV ที่ค่อนข้างแคบ ก่อตัวขึ้นทันทีเมื่อสารละลายของ AgC104 ที่มีลำดับ 10-4 โมล dm-3 ผสมกับ KX (X=Cl หรือ Br) สารละลายที่มีลำดับตั้งแต่ 10-2 ถึง 10-1 mol dm-3 ตามด้วยการสลายตัวอย่างรวดเร็วประมาณ 10 มิลลิวินาที โดยมีการก่อตัวของผลิตภัณฑ์ขั้นกลางที่มีการดูดกลืนแสง UV กว้างและการเปลี่ยนแปลงของสเปกตรัมช้าลงมาก ของผลิตภัณฑ์ระดับกลาง พวกเขาตีความสื่อกลางเป็น monodisperse cores (AgX) n ซึ่งประกอบด้วย n โมเลกุล และหา n จากอัตราส่วนที่ชัดเจน -dC/dt α Cn ที่ t=0 สำหรับความเข้มข้นเริ่มต้นต่างๆ ของสารตั้งต้น C AgXm (m-1) - (n=7 -10 สำหรับ AgCl, n=3-4 สำหรับ AgBr)

อย่างไรก็ตาม เนื่องจากสารตั้งต้น AgXm (m -1) สลายตัวในลักษณะที่ไม่อยู่กับที่ ทฤษฎีของนิวเคลียสกึ่งนิ่งจึงไม่นำมาใช้ในกระบวนการนี้ ดังนั้นค่าผลลัพธ์ของ n จึงไม่สอดคล้องกับ nค่าของนิวเคลียสวิกฤต หากผลิตภัณฑ์ขั้นกลางมีนิวเคลียส monodisperse nที่ก่อรูปขึ้นโดยสารเชิงซ้อนที่เป็นมอนอเมอร์ อัตราส่วน -dC/dt α C อาจไม่คงอยู่ ki − 1, ici − 1c1=ki, i − 1ci, ซึ่งกันและกันในปฏิกิริยาต่อเนื่อง c1 → c2 → c3 →… → cn − 1 → cn., และเฉพาะขั้นตอนสุดท้าย cn − 1 → cn นั้นไม่สามารถย้อนกลับได้ เช่น c1⇌c2⇌c3⇌… ⇌cn − 1 → cn.
นอกจากนี้ ควรสันนิษฐานว่าความเข้มข้นของกลุ่มตั้งแต่ 2 ถึง n-1 มีความเข้มข้นสมดุลเล็กน้อย อย่างไรก็ตาม ดูเหมือนว่าจะไม่มีพื้นฐานใดที่จะพิสูจน์สมมติฐานเหล่านี้ได้ ในทางกลับกัน เราพยายามคำนวณรัศมีของนิวเคลียสวิกฤตและสัมประสิทธิ์ความอิ่มตัวยิ่งยวด S เมื่อสิ้นสุดกระบวนการที่รวดเร็ว โดยใช้ γ=101 mJ m − 2 สำหรับลูกบาศก์ AgCl19 และ γ=109 mJ m − 2 สำหรับลูกบาศก์ AgBr20 สมมติว่าค่าของ n, 7-10 สำหรับ AgCl19 และ 3-4 สำหรับ AgBr20 นั้นเทียบเท่ากับขนาดของนิวเคลียส monodisperse, n วิธีการวิเคราะห์ conductometric การทบทวนซึ่งมีตั้งแต่การอนุมัติไปจนถึงการชื่นชม ทำให้เกิดเคมีเป็นวิทยาศาสตร์ใหม่
เป็นผลให้นักวิทยาศาสตร์ค้นพบสูตรต่อไปนี้: r=0.451 นาโนเมตร และ S=105 สำหรับ AgCl ที่มี n=9; r=0.358 นาโนเมตร และ S=1230 สำหรับ AgBr ที่มี n=4 เนื่องจากระบบของพวกมันเทียบได้กับระบบของ Davis และ Jones ซึ่งได้รับความอิ่มตัวยิ่งยวดวิกฤตของ AgCl ประมาณ 1.7-2.0 ที่ 25 °C การใช้การวัดค่าการนำไฟฟ้าแบบผสมโดยตรงในปริมาณที่เท่ากันของสารละลายในน้ำเจือจางของ AgNO3 และ KCl ค่า S ที่สูงมากอาจไม่สะท้อนถึงปัจจัยความอิ่มตัวของสีที่แท้จริงอยู่ในสมดุลกับนิวเคลียสระดับกลาง
การดูดซึมรังสียูวี
ดูเหมือนว่าจะสมเหตุสมผลมากกว่าที่จะระบุแอตทริบิวต์ตัวกลางที่มีการดูดกลืนแสง UV ในวงกว้างว่ามีขนาดใหญ่กว่านิวเคลียสทั่วไปมากโดยมีการกระจายขนาดกว้างที่เกิดจากปฏิกิริยาต่อเนื่องที่ไม่คงที่ การเปลี่ยนแปลงอย่างช้าๆ ของนิวเคลียสระดับกลางที่ตามมาดูเหมือนจะเกี่ยวข้องกับการเจริญเติบโตของพวกมันใน Ostwald

ในบริบทข้างต้น นักเคมีชาวอเมริกัน Nielsen ยังได้รับค่า nที่ใกล้เคียงกันประมาณ 12 และค่า S ที่เหมือนกันมากกว่า 103 สำหรับนิวเคลียสของอนุภาคแบเรียมซัลเฟตจากการวัดค่าความขุ่นเป็นฟังก์ชันของการอิ่มตัวยิ่งยวด โดยใช้ n=dlogJ / dlogC ในทฤษฎีที่คล้ายกับ Becher-Dering กับสูตร (1.3.37) แต่ให้ (n+ 1) แทน nเนื่องจากสารละลายของแบเรียมไอออนและซัลเฟตไอออนผสมกันโดยตรงในการทดลองนี้ นิวเคลียสชั่วคราวอย่างรวดเร็วควรสิ้นสุดทันทีหลังจากผสม และสิ่งที่วัดได้อาจเป็นอัตราการเติบโตเต็มที่ของ Ostwald ที่ตามมาอย่างช้าๆ และ/หรือการหลอมรวมของนิวเคลียสที่สร้างขึ้น เห็นได้ชัดว่านี่คือสาเหตุของค่า n ที่น้อยเกินสมควรและความอิ่มตัวของสีสูงมาก ดังนั้นเราจึงต้องทราบอีกครั้งว่าแหล่งกักเก็บของชนิดโมโนเมอร์บางชนิดที่ปล่อยออกมาเพื่อตอบสนองต่อการบริโภคของพวกมันนั้นจำเป็นเสมอเพื่อให้ได้นิวเคลียสกึ่งนิ่งในระบบปิด ทฤษฎีคลาสสิกของนิวเคลียสทั้งหมด รวมทั้งทฤษฎีเบเคอร์-ดอร์ริง ถือว่าเงื่อนไขดังกล่าวโดยปริยาย ความหมายของ conductometricวิธีการวิเคราะห์ได้รับในหัวข้อของบทความด้านบน
นักวิทยาศาสตร์คนอื่น ๆ ได้ตรวจสอบกระบวนการนิวเคลียสชั่วคราวของซิลเวอร์เฮไลด์โดยการทำปฏิกิริยาเรดิโอไลซิสแบบพัลซิ่งของน้ำที่มีเมทิลีนเฮไลด์และซิลเวอร์ไอออน ในระหว่างที่เมทิลีนเฮไลด์ถูกย่อยสลายเพื่อปล่อยไอออนเฮไลด์โดยอิเล็กตรอนไฮเดรตที่เกิดจากรังสีพัลซิ่งในช่วง จาก 4 ns ถึง 3 μs สเปกตรัมของผลิตภัณฑ์ถูกบันทึกโดยใช้โฟโตมัลติเพลเยอร์และกล้องส่องทางไกล และพบว่าสารตั้งต้นซิลเวอร์เฮไลด์โมโนเมอร์ก่อตัวในช่วงเวลาหนึ่งตามลำดับของไมโครวินาที ตามด้วยกระบวนการนิวเคลียสที่คล้ายกับที่ทานากะและอิวาซากิสังเกต ผลลัพธ์แสดงให้เห็นชัดเจนว่ากระบวนการนิวเคลียสของซิลเวอร์เฮไลด์โดยการผสมสารตั้งต้นโดยตรงประกอบด้วยสองขั้นตอนเบื้องต้น นั่นคือการก่อตัวของสารตั้งต้นโมโนเมอร์ที่มีลำดับ μs และการเปลี่ยนแปลงที่ตามมาเป็นนิวเคลียสของลำดับ 10 มิลลิวินาที ควรสังเกตว่าขนาดเฉลี่ยของนิวเคลียสอยู่ที่ประมาณ 10 นาโนเมตร
ความอิ่มตัว
เกี่ยวกับค่าสัมประสิทธิ์ความอิ่มตัวยิ่งยวดสำหรับนิวเคลียสของอนุภาค AgCl ในระบบเปิดซึ่งมีการนำสารตั้งต้นที่มีความเข้มข้นสูง เช่น AgNO3 และ KCl เข้าสู่สารละลายเจลาตินอย่างต่อเนื่องตลอดการตกตะกอน Strong และ Wey31 รายงาน 1.029 (80° C) - 1.260 (40°C) และ Leubner32 รายงาน 1.024 ที่ 60°C โดยประมาณจากการวัดอัตราการเติบโตของอนุภาคเมล็ด AgCl ที่สภาวะอิ่มตัวยิ่งยวดวิกฤต นี่คือแก่นแท้ของวิธี conductometric ของการวิเคราะห์เชิงปริมาณ
ในทางกลับกัน สำหรับระบบอนุภาค AgBr แบบเปิด บางส่วนค่าโดยประมาณของสัมประสิทธิ์การอิ่มตัวยิ่งยวดวิกฤต Scrit: Scrit∼- 1.5 ที่ 70 °C ตาม Wey และ Strong33 จากอัตราการเติบโตสูงสุดที่ขึ้นกับขนาดซึ่งกำหนดโดยการหาเกณฑ์การเกิดนิวเคลียสในอัตราต่างๆ ของการเพิ่มสารละลาย AgNO3 ลงใน KBr สารละลายในที่ที่มีอนุภาคของเมล็ดโดยไอพ่นคู่ Scrit=1.2-1.5 ที่ 25°C ตาม Jagannathan และ Wey34 เป็นปัจจัยความอิ่มตัวสูงสุดที่กำหนดจากสมการ Gibbs-Thomson พร้อมข้อมูลเกี่ยวกับขนาดเฉลี่ยต่ำสุดของนิวเคลียสที่สังเกตได้ด้วยกล้องจุลทรรศน์อิเล็กตรอนระหว่างขั้นตอนนิวเคลียสของการตกตะกอน AgBr แบบสองเจ็ท. วิธีนี้มีประสิทธิภาพมากเมื่อใช้วิธีการหาปริมาณการนำไฟฟ้า

เมื่อคำนวณค่า Scrit เหล่านี้ ได้ γ=140 mJ m − 2 เนื่องจากนิวเคลียสในระบบเปิดสอดคล้องกับกระบวนการของการอยู่รอดของนิวเคลียสตั้งไข่ที่สร้างขึ้นในเขตพื้นที่ที่มีความอิ่มตัวยิ่งยวดสูงมากใกล้ทางออกของสารตั้งต้น วิกฤต ความอิ่มตัวยิ่งยวดสอดคล้องกับความเข้มข้นของตัวถูกละลายในสภาวะสมดุลกับนิวเคลียสที่มีขนาดสูงสุด หากเราใช้ข้อมูลของ Sugimoto35 เกี่ยวกับรัศมีสูงสุดของนิวเคลียส AgBr ในระบบเปิด (.3 8.3 นาโนเมตร) ในทางทฤษฎี γ สำหรับลูกบาศก์ AgBr (=109 mJ m − 2) 3 จากนั้นปัจจัยความอิ่มตัวของสีวิกฤตยิ่งยวด Scrit จะถูกคำนวณเท่ากับ 1.36 ที่ 25°C (หาก γ ถูกสันนิษฐานว่าเป็น 140 mJ/m2 ดังนั้น Scrit=1.48)
ดังนั้น ในกรณีใด ๆ ความอิ่มตัวยิ่งยวดที่สำคัญในระบบเปิดของอนุภาคซิลเวอร์เฮไลด์มักจะต่ำกว่าความอิ่มตัวยิ่งยวดสูงสุด (อาจใกล้เคียงกับความอิ่มตัวยิ่งยวดวิกฤต) ในระบบปิด ทั้งนี้เนื่องจากรัศมีเฉลี่ยของนิวเคลียสที่เกิดขึ้นในเขตพื้นที่ของระบบเปิดนั้นใหญ่กว่า rmในระบบปิดอย่างมาก อาจเป็นเพราะการหลอมรวมของนิวเคลียสปฐมภูมิที่มีความเข้มข้นสูงในโซนเฉพาะที่ของระบบเปิดที่มีค่าสูง ความเข้มข้นของอิเล็กโทรไลต์ในท้องถิ่น
แอปพลิเคชัน
การใช้วิธีการไทเทรตแบบ conductometric สำหรับการบันทึกอย่างต่อเนื่องระหว่างกระบวนการของเอนไซม์ได้รับการศึกษาและวิเคราะห์อย่างกว้างขวาง วิธีวิเคราะห์ไฟฟ้าเคมีเกือบทั้งหมดใช้ปฏิกิริยาเคมีไฟฟ้า (โพเทนชิโอเมทรี โวลแทมเมทรี แอมเพอโรเมทรี คูลอมเมตรี)
วิธีการวิเคราะห์ conductometric เป็นวิธีที่ไม่มีปฏิกิริยาไฟฟ้าเคมีบนอิเล็กโทรดเลย หรือมีปฏิกิริยาทุติยภูมิที่สามารถละเลยได้ ดังนั้น ในวิธีนี้ คุณสมบัติที่สำคัญที่สุดของสารละลายอิเล็กโทรไลต์ในชั้นขอบคือค่าการนำไฟฟ้า ซึ่งจะแปรผันตามปฏิกิริยาทางชีวภาพที่หลากหลายพอสมควร
ผลประโยชน์
ไบโอเซนเซอร์แบบนำไฟฟ้ายังมีข้อดีเหนือกว่าทรานสดิวเซอร์ประเภทอื่นๆ ด้วย ประการแรก สามารถผลิตได้โดยใช้เทคโนโลยีมาตรฐานฟิล์มบางราคาประหยัด ควบคู่ไปกับการใช้วิธีการที่เหมาะสมที่สุดสำหรับการตรึงวัสดุชีวภาพ ส่งผลให้ทั้งต้นทุนหลักของอุปกรณ์และต้นทุนรวมของการวิเคราะห์ สำหรับไมโครไบโอเซนเซอร์ในตัว โหมดการวัดค่าส่วนต่างทำได้ง่าย ซึ่งจะชดเชยอิทธิพลจากภายนอกและปรับปรุงความแม่นยำในการวัดอย่างมาก
ข้อมูลแสดงให้เห็นอย่างชัดเจนถึงศักยภาพที่ยอดเยี่ยมของไบโอเซนเซอร์แบบ conductometric อย่างไรก็ตาม นี่ยังคงเป็นเทรนด์ที่ค่อนข้างใหม่ในไบโอเซนเซอร์ ดังนั้นการพัฒนาอุปกรณ์เชิงพาณิชย์จึงมีอนาคตที่สดใส
วิธีการใหม่
นักวิทยาศาสตร์บางคนได้อธิบายวิธีการทั่วไปในการวัด pKa โดยการนำไฟฟ้า วิธีนี้ใช้กันอย่างแพร่หลายจนถึงประมาณปี พ.ศ. 2475 (ก่อนใช้วิธีการวัดค่า pH) วิธี conductometric มีความไวต่ออุณหภูมิอย่างยิ่ง และไม่สามารถใช้วัดค่า pKa ที่ทับซ้อนกันได้ ข้อได้เปรียบที่เป็นไปได้สำหรับตัวอย่างที่ไม่มีโครโมโซมคือสามารถใช้ในสารละลายเจือจางมาก จนถึง 2.8 × 10-5 โมลาร์ ในช่วงไม่กี่ปีที่ผ่านมา มีการใช้ conductometry 87 เพื่อวัด pKa ของลิโดเคน แม้ว่าผลลัพธ์ที่ได้จะเป็น 0.7 ต่อหน่วยที่ต่ำกว่าค่า pH ที่ยอมรับโดยทั่วไป

Albert และ Sergeant ยังได้อธิบายวิธีการกำหนด pKa จากการวัดความสามารถในการละลายอีกด้วย ดังที่ได้กล่าวไว้ข้างต้น ความสามารถในการละลายขึ้นอยู่กับ pKa ดังนั้นหากวัดความสามารถในการละลายที่ค่า pH หลายค่าบนเส้นโค้ง pKa สามารถกำหนดได้ Peck และ Benet อธิบายวิธีการทั่วไปในการประมาณค่า pKa สำหรับสาร monoprotic, diprotic และ amphoteric โดยกำหนดชุดความสามารถในการละลายและการวัดค่า pH Hansen และ Hafliger ได้รับ pKa ของตัวอย่างซึ่งสลายตัวอย่างรวดเร็วโดยการไฮโดรไลซิสจากอัตราการละลายเริ่มต้นตามหน้าที่ของ pH ในอุปกรณ์จานหมุน ผลลัพธ์เข้ากันได้ดีกับผลลัพธ์ pH/UV แต่การสลายตัวทำให้วิธีหลังทำได้ยาก นี่คือคำอธิบายโดยรวมของวิธีการวิเคราะห์ conductometric






