ทุกคนในช่วงชีวิตของเขาต้องเผชิญกับร่างกายที่เป็นหนึ่งในสามสถานะของสสาร สถานะการรวมที่ง่ายที่สุดในการศึกษาคือก๊าซ ในบทความ เราจะพิจารณาแนวคิดของก๊าซในอุดมคติ ให้สมการสถานะของระบบ และให้ความสนใจกับคำอธิบายของอุณหภูมิสัมบูรณ์ด้วย
สถานะของแก๊ส
นักเรียนแต่ละคนมีความคิดที่ดีเกี่ยวกับสิ่งที่พวกเขากำลังพูดถึงเมื่อได้ยินคำว่า "แก๊ส" คำนี้เข้าใจว่าเป็นเนื้อหาที่สามารถครอบครองไดรฟ์ข้อมูลใด ๆ ที่มีให้ ไม่สามารถรักษารูปร่างไว้ได้ เพราะไม่สามารถต้านทานอิทธิพลภายนอกเพียงเล็กน้อยได้ นอกจากนี้ ก๊าซไม่ได้กักเก็บปริมาตร ซึ่งไม่เพียงแต่แยกความแตกต่างจากของแข็งเท่านั้น แต่ยังรวมถึงของเหลวด้วย
แก๊สก็เหมือนกับของเหลว ในกระบวนการเคลื่อนที่ของวัตถุที่เป็นของแข็งในก๊าซ สิ่งหลังขัดขวางการเคลื่อนที่นี้ แรงที่เกิดขึ้นเรียกว่าความต้านทาน ค่าของมันขึ้นอยู่กับความเร็วของร่างกายในแก๊ส
ตัวอย่างที่ชัดเจนของก๊าซ ได้แก่ อากาศ ก๊าซธรรมชาติที่ใช้สำหรับทำความร้อนในบ้านและการปรุงอาหาร ก๊าซเฉื่อย (Ne, Ar) ที่ใช้เติมหลอดเรืองแสงโฆษณา หรือใช้เพื่อสร้างสภาพแวดล้อมเฉื่อย (ไม่ก้าวร้าว ป้องกัน) เมื่อทำการเชื่อม.
แก๊สในอุดมคติ
ก่อนที่จะอธิบายกฎของแก๊สและสมการสถานะ คุณควรเข้าใจคำถามว่าแก๊สในอุดมคติคืออะไร แนวคิดนี้ถูกนำมาใช้ในทฤษฎีจลนพลศาสตร์ระดับโมเลกุล (MKT) ก๊าซในอุดมคติคือก๊าซใด ๆ ที่มีคุณสมบัติดังต่อไปนี้:
- อนุภาคที่ก่อตัวไม่มีปฏิสัมพันธ์กัน ยกเว้นการชนกันของกลไกโดยตรง
- ผลจากการชนกันของอนุภาคกับผนังของเรือหรือระหว่างตัวมันเอง พลังงานจลน์และโมเมนตัมของพวกมันจะถูกสงวนไว้ กล่าวคือ การชนนั้นถือว่ายืดหยุ่นอย่างยิ่ง
- อนุภาคไม่มีมิติ แต่มีมวลจำกัด นั่นคือ คล้ายกับจุดวัสดุ
ก๊าซทุกชนิดไม่เหมาะแต่มีอยู่จริง อย่างไรก็ตาม สำหรับการแก้ปัญหาในทางปฏิบัติหลายอย่าง การประมาณเหล่านี้ค่อนข้างใช้ได้และสามารถใช้ได้ มีกฎเชิงประจักษ์ทั่วไปที่กล่าวว่า โดยไม่คำนึงถึงลักษณะทางเคมี หากก๊าซมีอุณหภูมิสูงกว่าอุณหภูมิห้องและความดันลำดับชั้นบรรยากาศหรือต่ำกว่าก็ถือได้ว่าอุดมคติมีความแม่นยำสูงและสามารถใช้อธิบายได้ มัน.สูตรสมการก๊าซในอุดมคติของรัฐ
กฎหมายคลาเปยรอน-เมนเดเลเยฟ
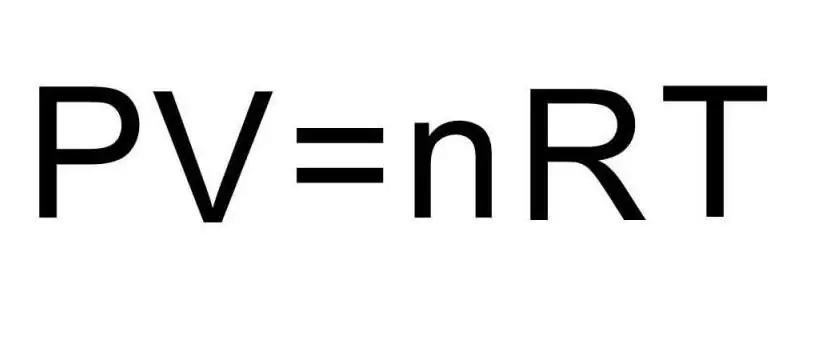
การเปลี่ยนแปลงระหว่างสถานะรวมของสสารและกระบวนการต่างๆ ภายในสถานะรวมเดียวได้รับการจัดการโดยเทอร์โมไดนามิกส์ ความดัน อุณหภูมิ และปริมาตรเป็นปริมาณสามปริมาณที่กำหนดสถานะใดๆ ของระบบเทอร์โมไดนามิกอย่างมีเอกลักษณ์ สูตรสำหรับสมการสถานะของก๊าซในอุดมคติรวมปริมาณทั้งสามนี้เป็นค่าความเท่าเทียมกันเดียว มาเขียนสูตรนี้กัน:
PV=nRT
ที่นี่ P, V, T - ความดัน ปริมาตร อุณหภูมิ ตามลำดับ ค่าของ n คือปริมาณของสารในหน่วยโมล และสัญลักษณ์ R หมายถึงค่าคงที่สากลของก๊าซ ความเท่าเทียมกันนี้แสดงว่ายิ่งผลิตผลของความดันและปริมาตรมากเท่าไร ก็ยิ่งต้องเป็นผลคูณของปริมาณของสารและอุณหภูมิมากขึ้นเท่านั้น

สูตรสมการสถานะของก๊าซเรียกว่ากฎของแคลเปย์รอน-เมนเดเลเยฟ ในปี พ.ศ. 2377 นักวิทยาศาสตร์ชาวฝรั่งเศส Emile Clapeyron ซึ่งสรุปผลการทดลองของรุ่นก่อนได้มาถึงสมการนี้ อย่างไรก็ตาม Clapeyron ใช้ค่าคงที่จำนวนหนึ่งซึ่งต่อมา Mendeleev แทนที่ด้วยหนึ่ง - ค่าคงที่ก๊าซสากล R (8, 314 J / (molK)) ดังนั้นในฟิสิกส์สมัยใหม่ สมการนี้จึงตั้งชื่อตามชื่อของนักวิทยาศาสตร์ชาวฝรั่งเศสและรัสเซีย

รูปแบบสมการอื่น
ด้านบน เราเขียนสมการ Mendeleev-Clapeyron ของสถานะสำหรับก๊าซในอุดมคติในค่าที่ยอมรับโดยทั่วไปและแบบฟอร์มที่สะดวก อย่างไรก็ตาม ในปัญหาทางอุณหพลศาสตร์ มักจะต้องใช้รูปแบบที่แตกต่างกันเล็กน้อย มีการเขียนสูตรอีกสามสูตรด้านล่าง ซึ่งเป็นไปตามสมการที่เขียนโดยตรง:
PV=NkBT;
PV=m/MRT;
P=ρRT/M.
สมการทั้งสามนี้เป็นสากลสำหรับก๊าซในอุดมคติเช่นกัน โดยจะมีปริมาณเช่นมวล m มวลโมลาร์ M ความหนาแน่น ρ และจำนวนอนุภาค N ที่ประกอบขึ้นเป็นระบบเท่านั้น สัญลักษณ์ kB ที่นี่แสดงถึงค่าคงที่ Boltzmann (1, 3810-23J/K)
กฎหมายบอยล์-มาริออตต์
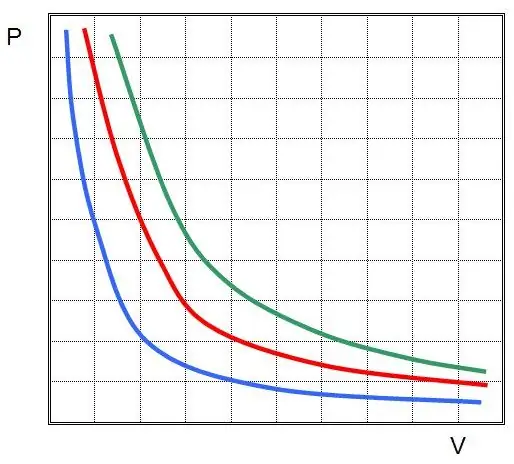
เมื่อ Clapeyron วาดสมการของเขาขึ้นมา เขามีพื้นฐานมาจากกฎของแก๊สที่ถูกค้นพบในการทดลองเมื่อหลายสิบปีก่อน หนึ่งในนั้นคือกฎหมาย Boyle-Mariotte มันสะท้อนถึงกระบวนการไอโซเทอร์มอลในระบบปิด ซึ่งเป็นผลมาจากการเปลี่ยนแปลงพารามิเตอร์ระดับมหภาค เช่น ความดันและปริมาตร ถ้าเราใส่ค่าคงที่ T และ n ในสมการสถานะของแก๊สในอุดมคติ กฎของแก๊สจะอยู่ในรูปแบบ:
P1V1=P2V 2
นี่คือกฎหมาย Boyle-Mariotte ซึ่งกล่าวว่าผลิตภัณฑ์ของแรงดันและปริมาตรจะถูกเก็บรักษาไว้ในระหว่างกระบวนการเก็บอุณหภูมิโดยพลการ ในกรณีนี้ ค่า P และ V จะเปลี่ยนเอง
ถ้าคุณพลอต P(V) หรือ V(P) แล้ว isotherms จะเป็นไฮเปอร์โบลา
กฎของชาร์ลส์และเกย์-ลุสแซก
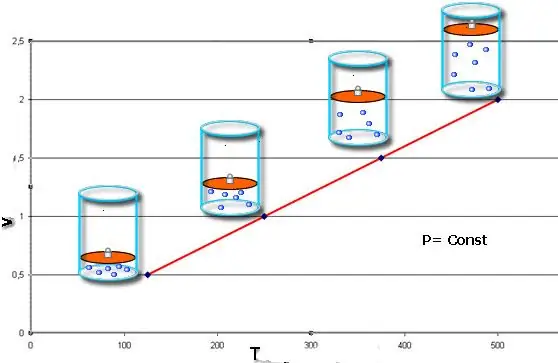
กฎเหล่านี้อธิบาย isobaric และ isochoric ในทางคณิตศาสตร์กระบวนการนั่นคือการเปลี่ยนแปลงดังกล่าวระหว่างสถานะของระบบแก๊สซึ่งความดันและปริมาตรถูกรักษาไว้ตามลำดับ กฎของชาร์ลส์สามารถเขียนทางคณิตศาสตร์ได้ดังนี้:
V/T=const เมื่อ n, P=const.
กฎของเกย์-ลูซซักเขียนดังนี้:
P/T=const เมื่อ n, V=const.
หากความเท่าเทียมกันทั้งสองแสดงอยู่ในรูปของกราฟ เราก็จะได้เส้นตรงที่เอียงในมุมหนึ่งไปยังแกน x กราฟประเภทนี้ระบุสัดส่วนโดยตรงระหว่างปริมาตรและอุณหภูมิที่ความดันคงที่และระหว่างความดันกับอุณหภูมิที่ปริมาตรคงที่
โปรดทราบว่ากฎของแก๊สทั้งสามที่พิจารณาแล้วไม่ได้คำนึงถึงองค์ประกอบทางเคมีของแก๊ส เช่นเดียวกับการเปลี่ยนแปลงของปริมาณสสาร
อุณหภูมิสัมบูรณ์
ในชีวิตประจำวัน เราคุ้นเคยกับการใช้มาตราส่วนอุณหภูมิเซลเซียส เนื่องจากสะดวกต่อการอธิบายกระบวนการรอบตัวเรา น้ำเดือดที่ 100 oC และแข็งตัวที่ 0 oC. ในวิชาฟิสิกส์มาตราส่วนนี้ไม่สะดวกดังนั้นจึงใช้มาตราส่วนอุณหภูมิสัมบูรณ์ที่เรียกว่าลอร์ดเคลวินในช่วงกลางศตวรรษที่ 19 ตามมาตราส่วนนี้ อุณหภูมิจะวัดเป็นเคลวิน (K)
เชื่อกันว่าที่อุณหภูมิ -273, 15 oC ไม่มีการสั่นสะเทือนจากความร้อนของอะตอมและโมเลกุล การเคลื่อนที่ไปข้างหน้าจะหยุดโดยสมบูรณ์ อุณหภูมินี้เป็นองศาเซลเซียสที่สอดคล้องกับศูนย์สัมบูรณ์ในเคลวิน (0 K) จากคำจำกัดความนี้ความหมายทางกายภาพของอุณหภูมิสัมบูรณ์มีดังนี้: เป็นการวัดพลังงานจลน์ของอนุภาคที่ประกอบเป็นสสาร เช่น อะตอมหรือโมเลกุล
นอกจากความหมายทางกายภาพข้างต้นของอุณหภูมิสัมบูรณ์แล้ว ยังมีวิธีอื่นๆ ในการทำความเข้าใจปริมาณนี้ หนึ่งในนั้นคือกฎแก๊สของชาร์ลส์ที่กล่าวถึง ลองเขียนในรูปแบบต่อไปนี้:
V1/T1=V2/T 2=>
V1/V2=T1/T 2.
ความเท่าเทียมกันครั้งสุดท้ายบอกว่าที่ปริมาณของสารในระบบ (เช่น 1 โมล) และความดันบางอย่าง (เช่น 1 Pa) ปริมาตรก๊าซจะกำหนดอุณหภูมิสัมบูรณ์โดยเฉพาะ กล่าวอีกนัยหนึ่ง การเพิ่มขึ้นของปริมาณก๊าซภายใต้เงื่อนไขเหล่านี้เป็นไปได้เพียงเนื่องจากอุณหภูมิที่เพิ่มขึ้น และปริมาตรที่ลดลงบ่งชี้ว่าค่าของ T.
ลดลง
จำได้ว่าอุณหภูมิสัมบูรณ์ไม่สามารถลบได้ไม่เหมือนอุณหภูมิเซลเซียส
หลักการอโวกาโดรและส่วนผสมของแก๊ส
นอกจากกฎก๊าซข้างต้นแล้ว สมการสถานะสำหรับก๊าซในอุดมคติยังนำไปสู่หลักการที่ Amedeo Avogadro ค้นพบเมื่อต้นศตวรรษที่ 19 ซึ่งมีนามสกุลของเขาอยู่ด้วย หลักการนี้กำหนดว่าปริมาตรของก๊าซใดๆ ที่ความดันคงที่และอุณหภูมิจะกำหนดโดยปริมาณของสารในระบบ สูตรที่สอดคล้องกันมีลักษณะดังนี้:
n/V=const เมื่อ P, T=const.
นิพจน์ที่เป็นลายลักษณ์อักษรนำไปสู่กฎของแก๊สผสมในอุดมคติของ D alton สำหรับแก๊สผสม นี้กฎหมายระบุว่าแรงดันบางส่วนของก๊าซในส่วนผสมจะถูกกำหนดโดยเศษส่วนของอะตอมอย่างเฉพาะเจาะจง
ตัวอย่างการแก้ปัญหา
ในภาชนะปิดที่มีผนังแข็งที่มีก๊าซในอุดมคติซึ่งเป็นผลมาจากความร้อน ความดันเพิ่มขึ้น 3 เท่า จำเป็นต้องกำหนดอุณหภูมิสุดท้ายของระบบหากค่าเริ่มต้นคือ 25 oC.
ขั้นแรก แปลงอุณหภูมิจากองศาเซลเซียสเป็นเคลวินกัน เรามี:
T=25 + 273, 15=298, 15 K.
เนื่องจากผนังของภาชนะมีความแข็ง กระบวนการให้ความร้อนจึงถือได้ว่าเป็นแบบไอโซโคริก สำหรับกรณีนี้ เราใช้กฎหมาย Gay-Lussac เรามี:
P1/T1=P2/T 2=>
T2=P2/P1T 1.
ดังนั้น อุณหภูมิสุดท้ายจะถูกกำหนดจากผลคูณของอัตราส่วนความดันและอุณหภูมิเริ่มต้น แทนที่ข้อมูลด้วยความเท่าเทียมกัน เราได้คำตอบ: T2=894.45 K. อุณหภูมินี้สอดคล้องกับ 621.3 oC.

