เมื่อศึกษาพฤติกรรมของก๊าซในทางฟิสิกส์ กระบวนการไอโซโพรเซสจะให้ความสนใจเป็นอย่างมาก กล่าวคือ การเปลี่ยนผ่านระหว่างสถานะของระบบ ซึ่งในระหว่างนั้นพารามิเตอร์ทางอุณหพลศาสตร์หนึ่งตัวจะถูกเก็บรักษาไว้ อย่างไรก็ตาม มีการเปลี่ยนสถานะก๊าซระหว่างรัฐ ซึ่งไม่ใช่กระบวนการไอโซโพรเซส แต่มีบทบาทสำคัญในธรรมชาติและเทคโนโลยี นี่เป็นกระบวนการอะเดียแบติก ในบทความนี้ เราจะพิจารณาในรายละเอียดเพิ่มเติม โดยเน้นที่เลขชี้กำลังของแก๊สอะเดียแบติก
กระบวนการอะเดียแบติก
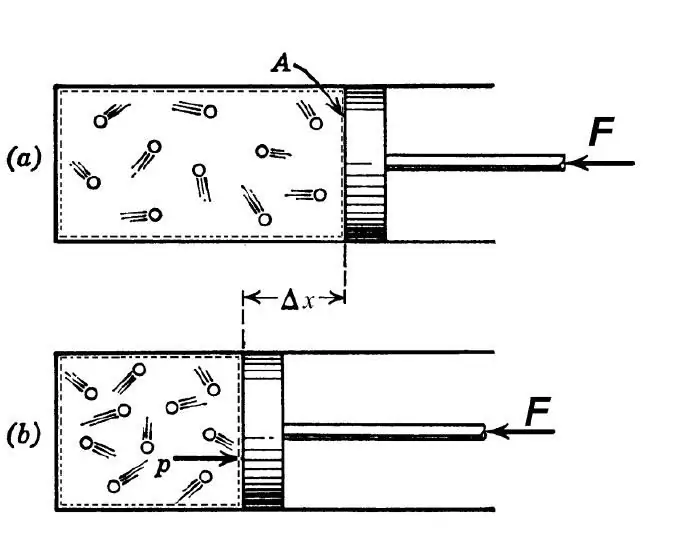
ตามคำจำกัดความทางเทอร์โมไดนามิกส์ กระบวนการอะเดียแบติกเป็นที่เข้าใจกันว่าเป็นการเปลี่ยนแปลงระหว่างสถานะเริ่มต้นและขั้นสุดท้ายของระบบ อันเป็นผลมาจากการที่ไม่มีการแลกเปลี่ยนความร้อนระหว่างสภาพแวดล้อมภายนอกกับระบบภายใต้การศึกษา กระบวนการดังกล่าวเป็นไปได้ภายใต้สองเงื่อนไขต่อไปนี้:
- การนำความร้อนระหว่างสภาพแวดล้อมภายนอกกับระบบต่ำด้วยเหตุผลอย่างใดอย่างหนึ่ง
- ความเร็วของกระบวนการสูง ดังนั้นการแลกเปลี่ยนความร้อนจึงไม่มีเวลาเกิดขึ้น
ในทางวิศวกรรม การเปลี่ยนผ่านแบบอะเดียแบติกใช้เพื่อทำให้แก๊สร้อนขึ้นในระหว่างการบีบอัดอย่างแหลมคม และเพื่อทำให้เย็นลงระหว่างการขยายตัวอย่างรวดเร็ว โดยธรรมชาติแล้ว การเปลี่ยนแปลงทางอุณหพลศาสตร์ที่เป็นปัญหาจะปรากฏขึ้นเมื่อมวลอากาศสูงขึ้นหรือตกลงมาจากเนินเขา การขึ้นลงดังกล่าวนำไปสู่การเปลี่ยนแปลงในจุดน้ำค้างในอากาศและปริมาณน้ำฝน
สมการปัวซองสำหรับแก๊สอุดมคติแบบอะเดียแบติก

ก๊าซในอุดมคติคือระบบที่อนุภาคเคลื่อนที่แบบสุ่มด้วยความเร็วสูง ไม่โต้ตอบซึ่งกันและกันและไม่มีมิติ โมเดลดังกล่าวใช้คำอธิบายทางคณิตศาสตร์ได้ง่ายมาก
ตามคำจำกัดความของกระบวนการอะเดียแบติก นิพจน์ต่อไปนี้สามารถเขียนตามกฎข้อที่หนึ่งของอุณหพลศาสตร์ได้:
dU=-PdV.
กล่าวอีกนัยหนึ่ง ก๊าซ การขยายหรือหดตัว ทำงาน PdV เนื่องจากการเปลี่ยนแปลงที่สอดคล้องกันในพลังงานภายใน dU
ในกรณีของก๊าซในอุดมคติ หากเราใช้สมการของรัฐ (กฎ Clapeyron-Mendeleev) เราจะได้นิพจน์ต่อไปนี้:
PVγ=const.
ความเท่าเทียมกันนี้เรียกว่าสมการปัวซอง คนที่คุ้นเคยกับฟิสิกส์ของแก๊สจะสังเกตว่าถ้าค่า γ เท่ากับ 1 สมการปัวซองจะเข้าสู่กฎของบอยล์-มาริออตต์ (ไอโซเทอร์มอล)กระบวนการ). อย่างไรก็ตาม การแปลงสมการดังกล่าวเป็นไปไม่ได้ เนื่องจาก γ สำหรับก๊าซในอุดมคติใดๆ มีค่ามากกว่าหนึ่ง ปริมาณ γ (แกมมา) เรียกว่าดัชนีอะเดียแบติกของก๊าซในอุดมคติ มาดูความหมายทางกายภาพของมันกันดีกว่า
เลขชี้กำลังอะเดียแบติกคืออะไร
เลขชี้กำลัง γ ซึ่งปรากฏในสมการปัวซองสำหรับก๊าซในอุดมคติ คืออัตราส่วนของความจุความร้อนที่ความดันคงที่ต่อค่าเดียวกัน แต่อยู่ที่ปริมาตรคงที่แล้ว ในทางฟิสิกส์ ความจุความร้อนคือปริมาณความร้อนที่ต้องถ่ายโอนไปยังหรือนำออกจากระบบที่กำหนดเพื่อให้อุณหภูมิเปลี่ยนแปลงไป 1 เคลวิน เราจะระบุความจุความร้อนไอโซบาริกด้วยสัญลักษณ์ CP และความจุความร้อนไอโซโคริกด้วยสัญลักษณ์ CV จากนั้นความเท่าเทียมกันจะถือเป็น γ:
γ=CP/CV.
เนื่องจาก γ มีค่ามากกว่าหนึ่งเสมอ มันแสดงให้เห็นว่าความจุความร้อนไอโซบาริกของระบบก๊าซที่ศึกษานั้นเกินคุณสมบัติไอโซโคริกที่คล้ายคลึงกันกี่ครั้ง
ความจุความร้อนของ CP และ CV
ในการหาเลขชี้กำลังอะเดียแบติก เราควรมีความเข้าใจที่ดีเกี่ยวกับความหมายของปริมาณ CP และ CV ในการทำเช่นนี้ เราจะทำการทดลองทางความคิดต่อไปนี้: ลองนึกภาพว่าก๊าซอยู่ในระบบปิดในภาชนะที่มีผนังทึบ หากภาชนะถูกทำให้ร้อน ความร้อนที่สื่อสารทั้งหมดจะถูกแปลงเป็นพลังงานภายในของก๊าซ ในสถานการณ์เช่นนี้ ความเท่าเทียมกันจะมีผลบังคับใช้:
dU=CVdT.
ความคุ้มค่าCVกำหนดปริมาณความร้อนที่ต้องถ่ายโอนไปยังระบบเพื่อให้ความร้อนแบบ isochorically 1 K.
ตอนนี้ สมมติว่าก๊าซอยู่ในภาชนะที่มีลูกสูบเคลื่อนที่ ในกระบวนการให้ความร้อนแก่ระบบดังกล่าว ลูกสูบจะเคลื่อนที่เพื่อให้แน่ใจว่ามีแรงดันคงที่ เนื่องจากเอนทาลปีของระบบในกรณีนี้จะเท่ากับผลคูณของความจุความร้อนไอโซบาริกและการเปลี่ยนแปลงของอุณหภูมิ กฎข้อที่หนึ่งของอุณหพลศาสตร์จะอยู่ในรูปแบบ:
CPdT=CVdT + PdV.
จากที่นี่ จะเห็นว่า CP>CV เนื่องจากในกรณีของการเปลี่ยนสถานะ isobaric จำเป็นต้อง ใช้ความร้อนไม่เพียงแต่เพิ่มอุณหภูมิของระบบ และด้วยเหตุนี้พลังงานภายในของระบบ แต่ยังรวมถึงงานที่ทำโดยแก๊สระหว่างการขยายตัวด้วย
ค่าของ γ สำหรับก๊าซโมโนในอุดมคติ
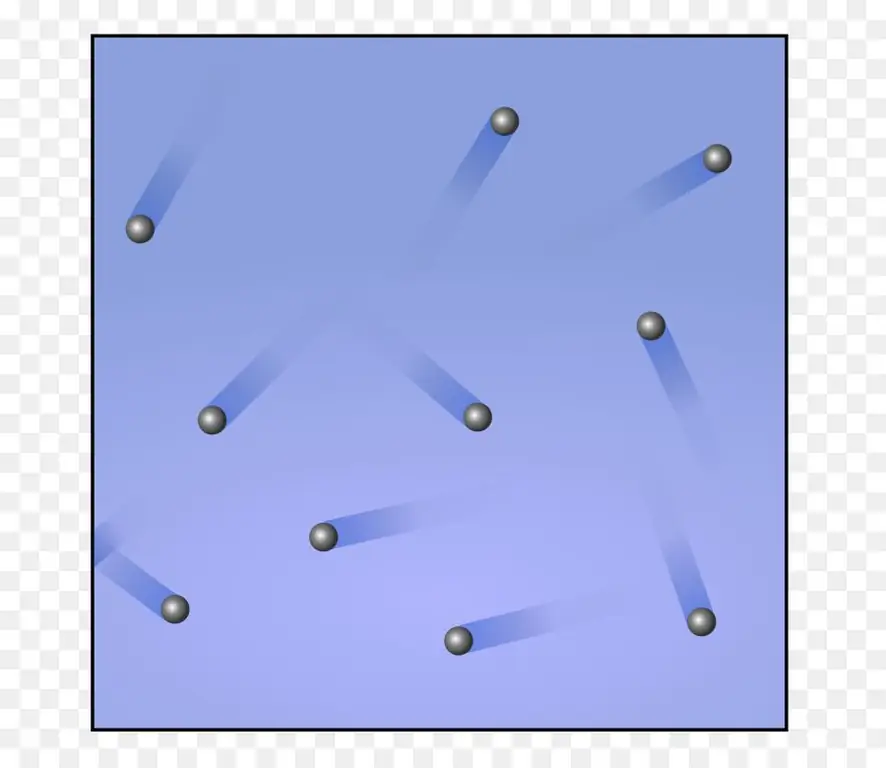
ระบบแก๊สที่ง่ายที่สุดคือแก๊สอุดมคติแบบโมโนโทมิก สมมติว่าเรามีก๊าซดังกล่าว 1 โมล โปรดจำไว้ว่าในกระบวนการให้ความร้อนไอโซบาริกของก๊าซ 1 โมลโดย 1 เคลวิน มันทำงานได้เท่ากับ R สัญลักษณ์นี้มักใช้เพื่อระบุค่าคงที่ก๊าซสากล เท่ากับ 8, 314 J / (molK) ใช้นิพจน์สุดท้ายในย่อหน้าก่อนหน้าสำหรับกรณีนี้ เราได้รับความเท่าเทียมกันดังต่อไปนี้:
CP=CV+ R.
จากที่ที่คุณสามารถกำหนดมูลค่าของความจุความร้อนไอโซโคริก CV:
γ=CP/CV;
CV=R/(γ-1).
มันขึ้นชื่อว่าโมลตัวเดียวmonatomic gas ค่าความจุความร้อน isochoric คือ:
CV=3/2R.
จากความเท่าเทียมกันสองอันสุดท้ายตามค่าของเลขชี้กำลังอะเดียแบติก:
3/2R=R/(γ-1)=>
γ=5/3 ≈ 1, 67.
โปรดทราบว่าค่าของ γ ขึ้นอยู่กับคุณสมบัติภายในของก๊าซเองเท่านั้น (ขึ้นอยู่กับธรรมชาติของโมเลกุลหลายอะตอม) และไม่ขึ้นอยู่กับปริมาณของสารในระบบ
การพึ่งพา γ กับจำนวนองศาอิสระ
สมการสำหรับความจุความร้อนไอโซโคริกของก๊าซโมโนโทมิกถูกเขียนไว้ด้านบน สัมประสิทธิ์ 3/2 ที่ปรากฎนั้นสัมพันธ์กับจำนวนองศาอิสระในหนึ่งอะตอม มันสามารถเคลื่อนที่ได้เพียงหนึ่งในสามทิศทางของอวกาศ นั่นคือ มีเพียงองศาอิสระที่แปลเท่านั้น
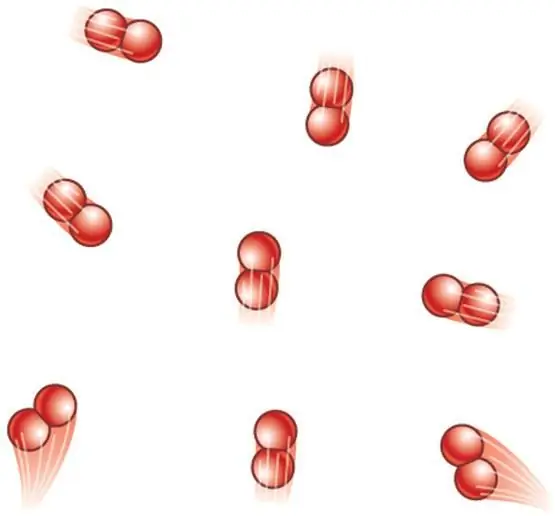
ถ้าระบบถูกสร้างขึ้นจากโมเลกุลไดอะตอมมิก จะมีการบวกองศาการหมุนอีกสององศาในการแปลผลทั้งสาม ดังนั้น นิพจน์สำหรับ CV กลายเป็น:
CV=5/2R.
จากนั้นค่าของ γ จะเป็น:
γ=7/5=1, 4.
โปรดทราบว่าจริง ๆ แล้วโมเลกุลไดอะตอมมีระดับความอิสระในการสั่นสะเทือนมากกว่า 1 ระดับ แต่ที่อุณหภูมิหลายร้อยเคลวิน โมเลกุลของไดอะตอมมิกจะไม่ทำงานและไม่ทำให้เกิดความจุความร้อน
ถ้าโมเลกุลของแก๊สประกอบด้วยอะตอมมากกว่า 2 อะตอม ก็จะมีอิสระ 6 ดีกรี เลขชี้กำลังอะเดียแบติกในกรณีนี้จะเท่ากับ:
γ=4/3 ≈ 1, 33.
โซดังนั้น เมื่อจำนวนอะตอมในโมเลกุลของแก๊สเพิ่มขึ้น ค่าของ γ จะลดลง หากคุณสร้างกราฟอะเดียแบติกในแกน P-V คุณจะสังเกตเห็นว่าเส้นโค้งของก๊าซโมโนมิกจะมีพฤติกรรมรุนแรงกว่ากราฟหลายอะตอม
เลขชี้กำลังอะเดียแบติกสำหรับส่วนผสมของก๊าซ
เราได้แสดงไว้ข้างต้นแล้วว่าค่าของ γ ไม่ได้ขึ้นอยู่กับองค์ประกอบทางเคมีของระบบแก๊ส อย่างไรก็ตาม ขึ้นอยู่กับจำนวนอะตอมที่ประกอบเป็นโมเลกุล สมมติว่าระบบประกอบด้วยองค์ประกอบ N เศษส่วนอะตอมของส่วนประกอบ i ในส่วนผสมคือ ai จากนั้น เพื่อหาเลขชี้กำลังอะเดียแบติกของของผสม คุณสามารถใช้นิพจน์ต่อไปนี้:
γ=∑i=1N(aiγ i).
โดยที่ γi คือค่า γ สำหรับองค์ประกอบที่ i
ตัวอย่างเช่น นิพจน์นี้สามารถใช้เพื่อกำหนด γ ของอากาศ เนื่องจากประกอบด้วยออกซิเจนและไนโตรเจนโมเลกุลไดอะตอม 99% ดัชนีอะเดียแบติกจึงควรใกล้เคียงกับค่า 1.4 มาก ซึ่งได้รับการยืนยันโดยการทดลองหาค่านี้

