ในอุณหพลศาสตร์ เมื่อศึกษาการเปลี่ยนจากสถานะเริ่มต้นเป็นสถานะสุดท้ายของระบบ สิ่งสำคัญคือต้องทราบผลกระทบทางความร้อนของกระบวนการ แนวคิดเรื่องความจุความร้อนมีความเกี่ยวข้องอย่างใกล้ชิดกับผลกระทบนี้ ในบทความนี้ เราจะพิจารณาคำถามว่าความจุความร้อนไอโซคอริกของแก๊สมีความหมายอย่างไร
แก๊สในอุดมคติ
ก๊าซในอุดมคติคือก๊าซที่อนุภาคถือว่าเป็นจุดวัสดุ กล่าวคือ พวกมันไม่มีมิติ แต่มีมวล และพลังงานภายในทั้งหมดประกอบด้วยพลังงานจลน์ของการเคลื่อนที่ของโมเลกุลเพียงอย่างเดียว และอะตอม
ก๊าซจริงใดๆ ก็ตามจะไม่เป็นไปตามรูปแบบที่อธิบายไว้ เนื่องจากอนุภาคของมันยังคงมีมิติเชิงเส้นอยู่บ้างและมีปฏิสัมพันธ์ซึ่งกันและกันโดยใช้พันธะแวนเดอร์วาลส์แบบอ่อนหรือพันธะเคมีประเภทอื่น อย่างไรก็ตาม ที่ความดันต่ำและอุณหภูมิสูง ระยะห่างระหว่างโมเลกุลจะมีขนาดใหญ่ และพลังงานจลน์ของพวกมันนั้นสูงกว่าพลังงานศักย์หลายสิบเท่า ทั้งหมดนี้ทำให้สามารถใช้แบบจำลองในอุดมคติสำหรับก๊าซจริงได้อย่างแม่นยำในระดับสูง
พลังงานภายในของแก๊ส
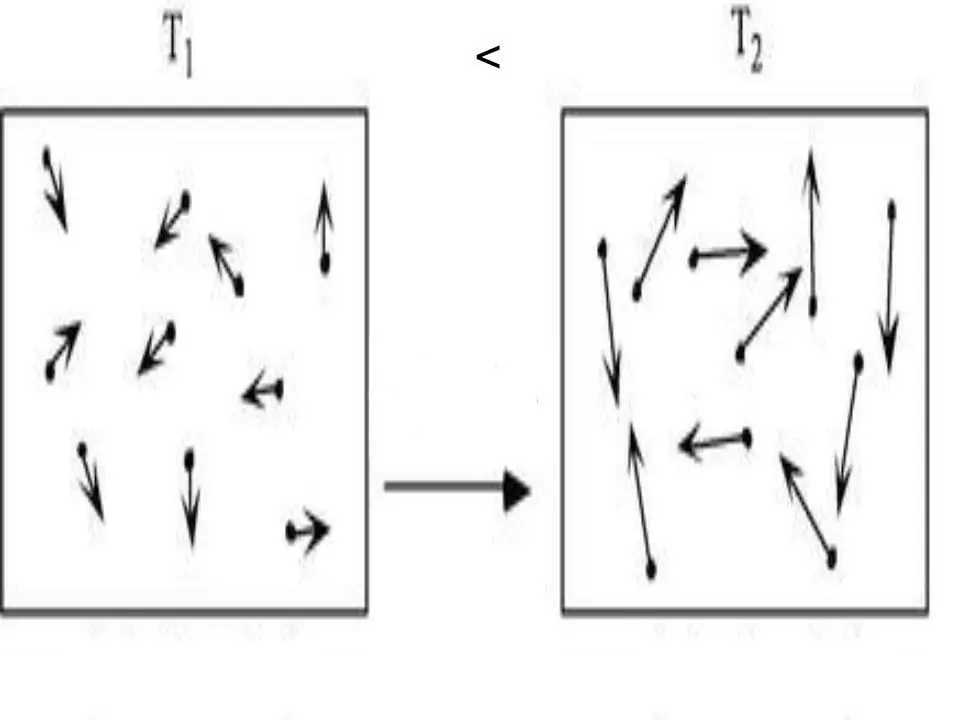
พลังงานภายในของระบบใด ๆ เป็นลักษณะทางกายภาพซึ่งเท่ากับผลรวมของศักย์และพลังงานจลน์ เนื่องจากพลังงานศักย์สามารถถูกละเลยในก๊าซอุดมคติ เราสามารถเขียนความเท่าเทียมกันสำหรับพวกมัน:
U=Ek.
โดยที่ Ek คือพลังงานของระบบจลนศาสตร์ การใช้ทฤษฎีจลนพลศาสตร์ระดับโมเลกุลและการใช้สมการสถานะ Clapeyron-Mendeleev สากล การหานิพจน์สำหรับ U ไม่ใช่เรื่องยาก เขียนไว้ด้านล่าง:
U=z/2nRT.
ที่นี่ T, R และ n คืออุณหภูมิสัมบูรณ์ ค่าคงที่ของแก๊ส และปริมาณของสารตามลำดับ ค่า z เป็นจำนวนเต็มที่ระบุจำนวนองศาอิสระที่โมเลกุลก๊าซมี
ความจุไอโซบาริกและไอโซโคริก
ในทางฟิสิกส์ ความจุความร้อนคือปริมาณความร้อนที่ต้องจัดเตรียมให้กับระบบที่กำลังศึกษาเพื่อให้ความร้อนหนึ่งเคลวิน คำจำกัดความย้อนกลับก็เป็นความจริงเช่นกัน กล่าวคือ ความจุความร้อนคือปริมาณความร้อนที่ระบบปล่อยออกมาเมื่อเย็นลงหนึ่งเคลวิน
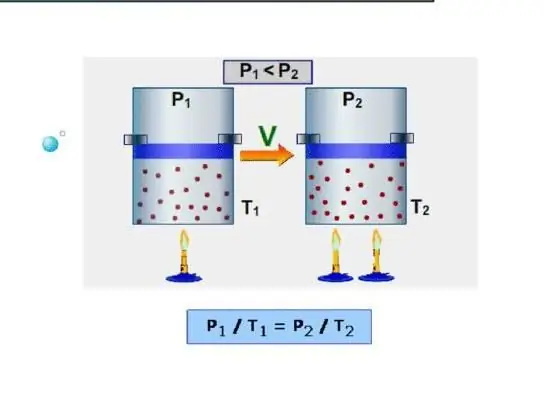
วิธีที่ง่ายที่สุดสำหรับระบบคือการกำหนดความจุความร้อนไอโซโคริก เป็นที่เข้าใจกันว่าความจุความร้อนที่ปริมาตรคงที่ เนื่องจากระบบไม่ทำงานภายใต้สภาวะดังกล่าว พลังงานทั้งหมดจึงถูกใช้ไปกับการเพิ่มพลังงานสำรองภายใน ให้เราระบุความจุความร้อนไอโซโคริกด้วยสัญลักษณ์ CV จากนั้นเราสามารถเขียน:
dU=CVdT.
นั่นคือการเปลี่ยนแปลงของพลังงานภายในระบบเป็นสัดส่วนโดยตรงกับการเปลี่ยนแปลงของอุณหภูมิ ถ้าเราเปรียบเทียบนิพจน์นี้กับความเท่าเทียมกันที่เขียนในย่อหน้าก่อนหน้า เราก็มาถึงสูตรสำหรับ CV ในก๊าซอุดมคติ:
СV=z/2nR.
ค่านี้ไม่สะดวกในทางปฏิบัติ เนื่องจากขึ้นอยู่กับปริมาณของสารในระบบ ดังนั้นจึงมีการแนะนำแนวคิดเกี่ยวกับความจุความร้อนไอโซโคริกจำเพาะ กล่าวคือ ค่าที่คำนวณต่อก๊าซ 1 โมลหรือต่อ 1 กิโลกรัม ให้เราระบุค่าแรกด้วยสัญลักษณ์ CV ที่สอง - โดยสัญลักษณ์ CV m. สำหรับพวกเขา คุณสามารถเขียนสูตรต่อไปนี้:
CV=z/2R;
CVm=z/2R/M.
นี่คือมวลโมเลกุล
Isobaric คือความจุความร้อนในขณะที่รักษาความดันในระบบให้คงที่ ตัวอย่างของกระบวนการดังกล่าวคือการขยายตัวของก๊าซในกระบอกสูบภายใต้ลูกสูบเมื่อถูกทำให้ร้อน ความร้อนที่จ่ายให้กับระบบนั้นต่างจากกระบวนการไอโซโคริก ระหว่างกระบวนการไอโซบาริก ความร้อนที่จ่ายให้กับระบบถูกใช้ไปเพื่อเพิ่มพลังงานภายในและเพื่อทำงานเชิงกล กล่าวคือ:
H=dU + PdV.
เอนทาลปีของกระบวนการไอโซบาริกเป็นผลคูณของความจุความร้อนไอโซบาริกและการเปลี่ยนแปลงของอุณหภูมิในระบบ นั่นคือ:
H=CPdT.
ถ้าเราพิจารณาการขยายตัวที่ความดันคงที่ของก๊าซ 1 โมล กฎข้อที่หนึ่งของอุณหพลศาสตร์จะเขียนเป็น:
CPdT=CV dT + RdT.
เทอมสุดท้ายได้มาจากสมการแคลเปย์รอน-เมนเดเลเยฟ จากความเท่าเทียมกันนี้จะเป็นไปตามความสัมพันธ์ระหว่างความจุความร้อนแบบไอโซบาริกและไอโซโคริก:
CP=CV + R.
สำหรับก๊าซในอุดมคติ ความจุความร้อนของโมลาร์จำเพาะที่ความดันคงที่มักจะมากกว่าคุณสมบัติไอโซโคริกที่สอดคล้องกันโดย R=8, 314 J/(molK) เสมอ
ระดับความอิสระของโมเลกุลและความจุความร้อน
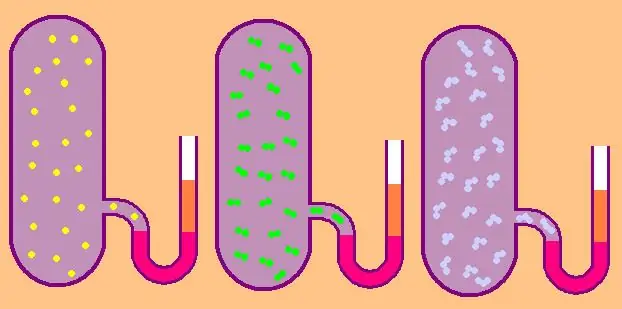
มาเขียนสูตรสำหรับความจุความร้อนไอโซโคริกของโมลาร์จำเพาะอีกครั้ง:
CV=z/2R.
ในกรณีของก๊าซโมโนโทมิก ค่า z=3 เนื่องจากอะตอมในอวกาศสามารถเคลื่อนที่ได้เพียงสามทิศทางเท่านั้น
ถ้าเรากำลังพูดถึงก๊าซที่ประกอบด้วยโมเลกุลไดอะตอมมิก เช่น ออกซิเจน O2 หรือไฮโดรเจน H2 ดังนั้น นอกจากการเคลื่อนที่แบบแปลนแล้ว โมเลกุลเหล่านี้ยังสามารถหมุนรอบแกนตั้งฉากสองแกน นั่นคือ z จะเท่ากับ 5.
สำหรับโมเลกุลที่ซับซ้อนมากขึ้น ใช้ z=6. เพื่อกำหนด CV

