ความจุความร้อนของแก๊สคือปริมาณพลังงานที่ร่างกายดูดซับเมื่อถูกทำให้ร้อน 1 องศา มาวิเคราะห์ลักษณะสำคัญของปริมาณทางกายภาพนี้กัน

คำจำกัดความ
ความร้อนจำเพาะของก๊าซคือมวลหน่วยของสารเฉพาะ หน่วยวัดคือ J/(kg·K) ปริมาณความร้อนที่ร่างกายดูดซับในกระบวนการเปลี่ยนสถานะการรวมตัวนั้นไม่เพียงสัมพันธ์กับสถานะเริ่มต้นและขั้นสุดท้ายเท่านั้น แต่ยังรวมถึงวิธีการเปลี่ยนด้วย

ภาควิชา
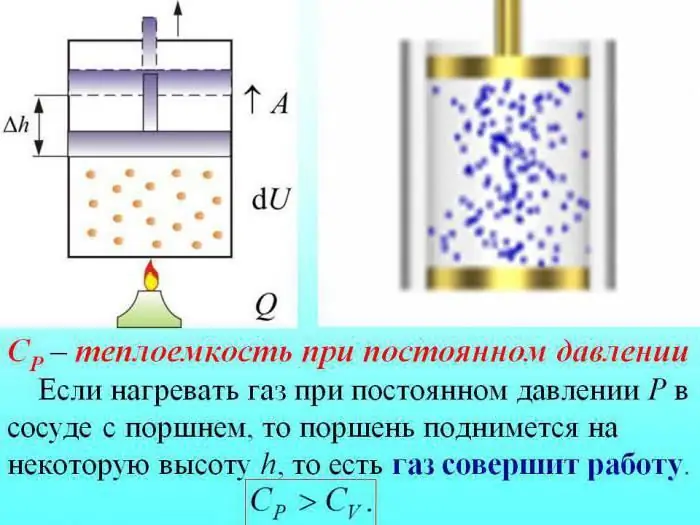
ความจุความร้อนของก๊าซหารด้วยค่าที่กำหนดที่ปริมาตรคงที่ (Cv) ความดันคงที่ (Cр)
ในกรณีที่ให้ความร้อนโดยไม่เปลี่ยนความดัน ความร้อนบางส่วนถูกใช้เพื่อผลิตการขยายตัวของแก๊ส และพลังงานบางส่วนถูกใช้เพื่อเพิ่มพลังงานภายใน
ความจุความร้อนของก๊าซที่ความดันคงที่ถูกกำหนดโดยปริมาณความร้อนที่ใช้ไปกับการเพิ่มพลังงานภายใน
สถานะแก๊ส: คุณสมบัติ คำอธิบาย
ความจุความร้อนของก๊าซในอุดมคตินั้นพิจารณาจากข้อเท็จจริงที่ว่า Сp-Сv=R ปริมาณหลังเรียกว่าค่าคงที่แก๊สสากล ค่าของมันสอดคล้องกับ 8.314 J/(mol K).
เมื่อทำการคำนวณตามทฤษฎีของความจุความร้อน เช่น การอธิบายความสัมพันธ์กับอุณหภูมิ ไม่เพียงพอที่จะใช้เฉพาะวิธีทางอุณหพลศาสตร์เท่านั้น สิ่งสำคัญคือต้องติดอาวุธให้กับตัวคุณเองด้วยองค์ประกอบของฟิสิกส์คงที่
ความจุความร้อนของก๊าซเกี่ยวข้องกับการคำนวณค่าเฉลี่ยของพลังงานของการเคลื่อนที่เชิงการแปลของโมเลกุลบางตัว การเคลื่อนไหวดังกล่าวสรุปได้จากการเคลื่อนที่แบบหมุนและเชิงแปลของโมเลกุล ตลอดจนจากการสั่นสะเทือนภายในของอะตอม
ในฟิสิกส์แบบคงที่ มีข้อมูลว่าสำหรับแต่ละระดับของอิสระในการเคลื่อนที่แบบหมุนและแบบแปลน จะมีปริมาณของก๊าซที่เท่ากับครึ่งหนึ่งของค่าคงที่แก๊สสากล

ข้อเท็จจริงที่น่าสนใจ
อนุภาคของก๊าซ monatomic ถือว่ามีระดับความเป็นอิสระในการแปลสามระดับ ดังนั้นความร้อนจำเพาะของก๊าซจึงมีสามระดับการแปล การหมุนสองครั้ง และหนึ่งองศาอิสระในการสั่นสะเทือน กฎของการกระจายแบบสม่ำเสมอทำให้เกิดความร้อนจำเพาะที่ปริมาตรคงที่เท่ากับ R
ในระหว่างการทดลอง พบว่าความจุความร้อนของก๊าซไดอะตอมมิกสอดคล้องกับค่า R ความคลาดเคลื่อนระหว่างทฤษฎีและการปฏิบัติดังกล่าวอธิบายได้จากข้อเท็จจริงที่ว่าความจุความร้อนของก๊าซในอุดมคตินั้นสัมพันธ์กับควอนตัม ผลกระทบ ดังนั้น เมื่อทำการคำนวณ สิ่งสำคัญคือต้องใช้สถิติตามควอนตัมช่างเครื่อง
บนพื้นฐานของกลศาสตร์ควอนตัม ระบบของอนุภาคใดๆ ที่แกว่งหรือหมุน ซึ่งรวมถึงโมเลกุลของแก๊ส มีค่าพลังงานที่ไม่ต่อเนื่องเพียงบางส่วน
หากพลังงานของการเคลื่อนที่ด้วยความร้อนในระบบไม่เพียงพอที่จะกระตุ้นการสั่นของความถี่ที่แน่นอน การเคลื่อนไหวดังกล่าวจะไม่ส่งผลต่อความจุความร้อนทั้งหมดของระบบ
ด้วยเหตุนี้ ระดับเสรีภาพจำเพาะจึง "ถูกแช่แข็ง" จึงเป็นไปไม่ได้ที่จะนำกฎความเท่าเทียมกันมาใช้กับมัน
ความจุความร้อนของก๊าซเป็นลักษณะสำคัญของสถานะที่การทำงานของระบบอุณหพลศาสตร์ทั้งหมดขึ้นอยู่กับ
อุณหภูมิที่กฎความเท่าเทียมกันสามารถนำไปใช้กับระดับความสั่นสะเทือนหรือการหมุนอิสระได้นั้นมีลักษณะเฉพาะโดยทฤษฎีควอนตัม เชื่อมโยงค่าคงที่พลังค์กับค่าคงที่โบลต์ซมันน์

ก๊าซไดอะตอมมิก
ช่องว่างระหว่างระดับพลังงานหมุนเวียนของก๊าซดังกล่าวมีองศาเพียงเล็กน้อย ข้อยกเว้นคือไฮโดรเจน ซึ่งค่าอุณหภูมิกำหนดหลายร้อยองศา
นั่นคือเหตุผลที่ว่าทำไมความจุความร้อนของก๊าซที่ความดันคงที่จึงเป็นเรื่องยากที่จะอธิบายโดยกฎการกระจายแบบสม่ำเสมอ ในสถิติควอนตัม เมื่อพิจารณาความจุความร้อน จะพิจารณาว่าส่วนที่สั่นสะท้าน ในกรณีที่อุณหภูมิลดลง จะลดลงอย่างรวดเร็วและถึงศูนย์
ปรากฏการณ์นี้อธิบายความจริงที่ว่าที่อุณหภูมิห้องแทบไม่มีส่วนที่สั่นสะเทือนของความจุความร้อนสำหรับก๊าซไดอะตอมมิกสอดคล้องกับค่าคงที่ R
ความจุความร้อนของก๊าซที่ปริมาตรคงที่ในกรณีของตัวบ่งชี้อุณหภูมิต่ำถูกกำหนดโดยใช้สถิติควอนตัม มีหลักการของ Nernst ซึ่งเรียกว่ากฎข้อที่สามของอุณหพลศาสตร์ ตามสูตร ความจุความร้อนกรามของก๊าซจะลดลงตามอุณหภูมิที่ลดลง มีแนวโน้มเป็นศูนย์

คุณสมบัติของของแข็ง
หากสามารถอธิบายความจุความร้อนของส่วนผสมของก๊าซได้โดยใช้สถิติควอนตัม สำหรับสถานะของแข็งของการรวมตัว การเคลื่อนที่ด้วยความร้อนจะแสดงลักษณะเฉพาะโดยความผันผวนเล็กน้อยของอนุภาคใกล้กับตำแหน่งสมดุล
อะตอมแต่ละอันมีระดับความอิสระในการสั่นสะเทือนสามระดับ ดังนั้นตามกฎหมายว่าด้วยพาร์ทิชัน ความจุความร้อนโมลาร์ของของแข็งสามารถคำนวณได้เป็น 3nR โดยที่ n เป็นจำนวนอะตอมในโมเลกุล
ในทางปฏิบัติ ตัวเลขนี้คือขีดจำกัดความจุความร้อนของวัตถุแข็งที่อุณหภูมิสูง
สามารถรับได้สูงสุดที่อุณหภูมิปกติสำหรับธาตุบางชนิด รวมถึงโลหะด้วย สำหรับ n=1 เป็นไปตามกฎหมาย Dulong และ Petit แต่สำหรับสารที่ซับซ้อน การเข้าถึงขีดจำกัดดังกล่าวค่อนข้างยาก เนื่องจากไม่สามารถหาขีดจำกัดได้ในความเป็นจริง การสลายตัวหรือการหลอมเหลวของของแข็งจึงเกิดขึ้น
ประวัติทฤษฎีควอนตัม
ผู้ก่อตั้งทฤษฎีควอนตัมคือ Einstein และ Debye เมื่อต้นศตวรรษที่ 20 มันขึ้นอยู่กับการหาปริมาณของการเคลื่อนที่แบบสั่นของอะตอมในบางส่วนคริสตัล ในกรณีของตัวบ่งชี้อุณหภูมิต่ำ ความจุความร้อนของตัวของแข็งจะกลายเป็นสัดส่วนโดยตรงกับค่าสัมบูรณ์ที่นำมาลูกบาศก์ ความสัมพันธ์นี้เรียกว่ากฎของเด็บบี้ เกณฑ์ที่ทำให้สามารถแยกความแตกต่างระหว่างตัวบ่งชี้อุณหภูมิต่ำและสูง เปรียบเทียบกับอุณหภูมิ Debye
ค่านี้ถูกกำหนดโดยสเปกตรัมของการสั่นสะเทือนของอะตอมในร่างกาย ดังนั้นมันจึงขึ้นอยู่กับคุณสมบัติของโครงสร้างผลึกของมันอย่างจริงจัง
QD คือค่าที่มีหลายร้อย K แต่ตัวอย่างเช่น เพชรมีค่าสูงกว่ามาก
อิเล็กตรอนนำไฟฟ้ามีส่วนสำคัญต่อความจุความร้อนของโลหะ ในการคำนวณจะใช้สถิติควอนตัมของ Fermi ค่าการนำไฟฟ้าอิเล็กทรอนิกส์สำหรับอะตอมของโลหะเป็นสัดส่วนโดยตรงกับอุณหภูมิสัมบูรณ์ เนื่องจากเป็นค่าที่ไม่มีนัยสำคัญ จึงนำมาพิจารณาเฉพาะที่อุณหภูมิที่มีแนวโน้มเป็นศูนย์สัมบูรณ์เท่านั้น
วิธีการกำหนดความจุความร้อน
วิธีทดลองหลักคือการวัดความร้อน ในการคำนวณความจุความร้อนตามทฤษฎี จะใช้เทอร์โมไดนามิกส์ทางสถิติ ใช้ได้กับก๊าซในอุดมคติ เช่นเดียวกับวัตถุที่เป็นผลึก โดยอาศัยข้อมูลการทดลองเกี่ยวกับโครงสร้างของสสาร
วิธีเชิงประจักษ์สำหรับการคำนวณความจุความร้อนของก๊าซในอุดมคตินั้นขึ้นอยู่กับแนวคิดของโครงสร้างทางเคมี การมีส่วนร่วมของกลุ่มอะตอมแต่ละกลุ่มในСр
สำหรับของเหลวก็ใช้วิธีที่ใช้เทอร์โมไดนามิกส์เช่นกันวัฏจักรที่ทำให้สามารถส่งผ่านจากความจุความร้อนของก๊าซในอุดมคติไปยังของเหลวผ่านอนุพันธ์ของอุณหภูมิของเอนทาลปีของกระบวนการระเหยได้
ในกรณีของสารละลาย ไม่อนุญาตให้คำนวณความจุความร้อนเป็นฟังก์ชันเสริม เนื่องจากโดยพื้นฐานแล้วค่าที่เกินของความจุความร้อนของสารละลายมีนัยสำคัญ
เพื่อประเมิน เราต้องการทฤษฎีการแก้ปัญหาทางสถิติระดับโมเลกุล สิ่งที่ยากที่สุดคือการระบุความจุความร้อนของระบบที่แตกต่างกันในการวิเคราะห์ทางอุณหพลศาสตร์

สรุป
การศึกษาความจุความร้อนทำให้คุณสามารถคำนวณสมดุลพลังงานของกระบวนการที่เกิดขึ้นในเครื่องปฏิกรณ์เคมี เช่นเดียวกับในอุปกรณ์การผลิตเคมีอื่นๆ นอกจากนี้ ค่านี้จำเป็นสำหรับการเลือกประเภทของสารหล่อเย็นที่เหมาะสม
ในปัจจุบัน การทดลองหาความจุความร้อนของสารในช่วงเวลาต่างๆ ของอุณหภูมิ - จากค่าต่ำไปจนถึงค่าสูง - เป็นตัวเลือกหลักในการกำหนดลักษณะทางอุณหพลศาสตร์ของสาร ในการคำนวณเอนโทรปีและเอนทาลปีของสสาร จะใช้อินทิกรัลความจุความร้อน ข้อมูลเกี่ยวกับความจุความร้อนของสารเคมีในช่วงอุณหภูมิที่กำหนดช่วยให้คุณคำนวณผลกระทบทางความร้อนของกระบวนการได้ ข้อมูลเกี่ยวกับความจุความร้อนของสารละลายทำให้สามารถคำนวณพารามิเตอร์ทางอุณหพลศาสตร์ที่ค่าอุณหภูมิใดๆ ภายในช่วงเวลาที่วิเคราะห์ได้
ตัวอย่างเช่น ของเหลวมีลักษณะเป็นค่าใช้จ่ายส่วนหนึ่งของความร้อนเพื่อเปลี่ยนค่าของพลังงานศักย์โมเลกุลที่ทำปฏิกิริยา ค่านี้เรียกว่าความจุความร้อน "การกำหนดค่า" ซึ่งใช้เพื่ออธิบายวิธีแก้ปัญหา
เป็นการยากที่จะทำการคำนวณทางคณิตศาสตร์ที่ครบถ้วนโดยไม่คำนึงถึงลักษณะทางอุณหพลศาสตร์ของสสาร สถานะของการรวมตัว นั่นคือเหตุผลที่ใช้ของเหลว ก๊าซ ของแข็ง เช่น ความจุความร้อนจำเพาะ ซึ่งทำให้สามารถระบุลักษณะพารามิเตอร์พลังงานของสารได้

